
DINÁMICAS DE LOS MACRÓFAGOS EN LA INFLAMACIÓN CRÓNICA Y ENFERMEDADES AUTOINMUNES: DEL EJE IL-17 A NUEVAS ESTRATEGIAS TERAPÉUTICAS
DECIPHERING MACROPHAGE DYNAMICS IN CHRONIC INFLAMMATION AND AUTOIMMUNITY: FROM IL-17 SIGNALING TO NOVEL THERAPEUTIC APPROACHES
Vol. 9 Núm. 3. Mayo 2025 - Julio 2025.
ISSN: 2530-5468
DOI: 10.5281/zenodo.15798524
Sanum. vol. 9, número 3 (2025) páginas 28 – 43
AUTORES:
Tomas Omar Zamora Bastidas, M.D- Esp. Neurólogo, Departamento de Medicina Interna, Profesor Titular de la Universidad del Cauca, Facultad Ciencias de la Salud. Popayán, Colombia.
Jonathan Alexander Cerón López M.D- Egresado, Universidad del Cauca, Popayán, Colombia.
Fleider Leovani Gómez Cabrera M.D- Egresado, Universidad de Nariño Pasto, Nariño, Colombia.
Tipo de artículo: Artículo de Revisión.
Sección: Medicina General.
Fecha recepción: 07-04-2025
Fecha aceptación: 09-06-2025
RESUMEN
La inflamación es un proceso biológico fundamental para la defensa del organismo frente a infecciones, lesiones y estímulos dañinos, y su regulación es esencial para restablecer la homeostasis; cuando se desregula, puede originar inflamación crónica, contribuyendo al desarrollo de trastornos autoinmunes, enfermedades cardiovasculares y cáncer. Esta revisión se propone dilucidar el papel crítico de los macrófagos en la modulación de la respuesta inflamatoria, enfatizando la señalización de IL-17 y explorando nuevas estrategias terapéuticas, como la modulación del receptor GPR37 y la tecnología de macrófagos gelificados. Métodos: Se realizó una búsqueda sistemática en las bases de datos PubMed, Scopus y Nature, utilizando términos específicos (“inflamación”, “macrófagos”, “IL-17”, “sepsis”, “terapéutica”) y siguiendo las directrices PRISMA para seleccionar estudios experimentales, revisiones y protocolos de cultivo publicados en las últimas décadas. Los hallazgos indican que la vía IL-17 influye en la activación de células T y en la migración de macrófagos, modulando su polarización en fenotipos M1/M2 y contribuyendo a la patogénesis de diversas enfermedades; además, se identificaron innovaciones terapéuticas prometedoras en el tratamiento de la sepsis y condiciones crónicas. Esta revisión aporta una base teórica sólida para el diseño de terapias personalizadas, resaltando la necesidad de ensayos clínicos robustos y protocolos estandarizados.
PALABRAS CLAVE:
Inflamación;
Macrófagos;
Interleucina-17;
Sepsis;
Terapéutica.
ABSTRACT:
Inflammation is a fundamental biological process essential for the defense of the organism against infections, injuries, and harmful stimuli, and its regulation is crucial for restoring homeostasis. When dysregulated, it can lead to chronic inflammation, thereby contributing to the development of autoimmune disorders, cardiovascular diseases, and cancer. This review aims to elucidate the critical role of macrophages in modulating the inflammatory response, with a particular emphasis on IL-17 signaling, and to explore novel therapeutic strategies such as the modulation of the GPR37 receptor and gelated macrophage technology. A systematic literature search was conducted in the PubMed, Scopus, and Nature databases using specific terms (“inflammation”, “macrophages”, “IL-17”, “sepsis”, “therapeutics”) and following PRISMA guidelines to select experimental studies, reviews, and culture protocols published over recent decades. The findings indicate that the IL-17 pathway significantly influences T cell activation and macrophage migration, modulating their polarization into M1/M2 phenotypes and contributing to the pathogenesis of various diseases, while also revealing promising therapeutic innovations for the treatment of sepsis and chronic conditions.This review provides a robust theoretical foundation for the design of personalized therapies, highlighting the need for rigorous clinical trials and standardized protocols.
KEYWORDS:
Inflammation;
Macrophages;
Interleukin-17;
Sepsis;
Therapeutics.
INTRODUCCIÓN:
La inflamación crónica y las enfermedades autoinmunes representan desafíos significativos en la práctica clínica actual, y en este contexto, los macrófagos emergen como piezas fundamentales en la regulación del sistema inmunológico. En la presente revisión, se exploran las dinámicas de estos versátiles fagocitos, desde la influencia del eje IL-17 hasta el desarrollo de nuevas estrategias terapéuticas, con el fin de dilucidar mecanismos y proponer alternativas de intervención. Este enfoque resulta especialmente relevante, ya que los macrófagos no solo participan en la eliminación de patógenos, sino que también modulan la respuesta inflamatoria, influyendo en la progresión de diversas enfermedades crónicas y auto-inmunes (1,2,3,4,5,6).
En cuanto al contexto, diversos estudios han demostrado que la polarización de los macrófagos en fenotipos M1 y M2 es crucial para determinar el curso de la inflamación. Además, la señalización mediada por IL-17 ha cobrado relevancia en la activación y migración de estas células, configurándose como un eje central en la patogénesis de condiciones como la sepsis, el lupus y la artritis reumatoide. Así, comprender estos procesos se vuelve vital para avanzar en terapias más específicas y personalizadas (1,2,3,4,5,6).
Los objetivos de esta revisión se centran en responder preguntas clave: ¿Cómo influye IL-17 en la activación y función de los macrófagos? ¿Qué nuevas estrategias terapéuticas emergen a partir del estudio de estos mecanismos? ¿Cuáles son los desafíos y limitaciones actuales en la aplicación clínica de estos hallazgos? Por ello, se analizaron estudios experimentales, revisiones y protocolos de cultivo publicados en las últimas décadas.
El alcance de esta revisión se delimita a investigaciones con rigor metodológico, abarcando tanto modelos animales como ensayos en humanos, lo que permite integrar perspectivas diversas y actualizadas para orientar futuras intervenciones terapéuticas en el ámbito de la inflamación crónica y las enfermedades autoinmunes. Adicionalmente, se impulsa la investigación para mejorar significativamente el bienestar del paciente.
METODOLOGÍA:
Para elaborar esta revisión, realizamos una búsqueda sistemática en las bases de datos PubMed, Scopus y Nature. Utilizamos palabras clave como “inflamación”, “macrófagos”, “IL-17”, “sepsis” y “terapéutica”, combinándolas cuidadosamente para capturar estudios relevantes. De manera amigable y meticulosa, seleccionamos aquellos artículos que ofrecían datos experimentales, revisiones y protocolos de cultivo, publicados en inglés o español y validados por pares. Asimismo, descartamos investigaciones sin aportes experimentales significativos o sin revisión por pares, lo que garantizó la calidad y pertinencia de la información. Siguiendo las directrices PRISMA, examinamos títulos, resúmenes y textos completos, asegurando la inclusión de estudios rigurosos y actuales. Este proceso permitió integrar diversas perspectivas y enfoques, contribuyendo a clarificar el papel de los macrófagos en la inflamación crónica y en las enfermedades autoinmunes, y abriendo nuevas perspectivas para estrategias terapéuticas innovadoras. Asimismo, este riguroso proceso metodológico nos brindó una visión sumamente actualizada de las innovaciones terapéuticas en el ámbito.
RESULTADOS:
La inflamación constituye un proceso biológico esencial que se activa frente a infecciones, lesiones o estímulos dañinos, siendo vital para la defensa del organismo; en respuesta a dichos insultos se desencadena una compleja cascada de eventos moleculares en la que intervienen células inmunitarias como neutrófilos, linfocitos y macrófagos, además de mediadores específicos como citoquinas, quimiocinas y prostaglandinas (1,2,3,4,5,6), por lo que el objetivo primordial es restablecer la homeostasis tisular, aunque cuando esta respuesta se desregula puede originar inflamación crónica, lo cual contribuye al desarrollo de trastornos autoinmunes, enfermedades cardiovasculares y cáncer (1,2,3,4,5,6); en este contexto, los macrófagos adquieren una relevancia especial, puesto que no solo eliminan patógenos y restos celulares, sino que también modulan la respuesta inflamatoria mediante la liberación de citoquinas proinflamatorias, por ejemplo, TNF-α, IL-1β e IL-6, y gracias a su capacidad para polarizarse en fenotipos M1 o M2 según el microambiente (1,2,3,4,5,6); asimismo, dentro del entramado inmunológico estos fagocitos desempeñan un papel crucial en la respuesta mediada por IL-17, dado que dicha citoquina, producida por células inmunitarias, no solo induce la quimiotaxis de neutrófilos mediante la estimulación de quimiocinas, sino que activa funciones específicas en los macrófagos; por ejemplo, diversos estudios han demostrado que estos fagocitos expresan subunidades del receptor IL-17, concretamente IL-17RA e IL-17RC, de forma variable según su localización, de modo que los macrófagos inflamatorios (Ly6C^hi) presentes en zonas mucosas, como la lámina propia intestinal y la cavidad peritoneal, exhiben niveles significativamente superiores de estos receptores en comparación con los macrófagos residentes (Ly6C^lo), lo que sugiere una preparación especial para responder a las señales de IL-17 (1,6).
Además, la activación a través de IL-17 estimula la producción de un perfil único de citocinas y quimiocinas, tales como GM-CSF, IL-3, IL-12p70 y CCL5, que intensifican la inflamación local y modulan la respuesta de las células T CD4+ al favorecer la generación de IFN-γ (1); asimismo, en modelos experimentales se ha observado que la deficiencia del receptor IL-17RA reduce la capacidad de los macrófagos para actuar como células presentadoras de antígenos, lo que a su vez disminuye la activación de células T (2,3,5,6), y la regulación de IL-17RA e IL-17RC en respuesta a estímulos como el peptidoglicano y los oligonucleótidos CpG refuerza la idea de una sensibilidad ajustable según el entorno, puesto que en enfermedades inflamatorias del corazón, como la miocarditis autoinmune, los macrófagos infiltrantes muestran niveles elevados de estos receptores, lo que se asocia a un mayor daño tisular; en contraste, su ausencia en modelos murinos favorece un predominio de macrófagos residentes, destacando así el papel de IL-17 en la polarización y migración celular (Ver Figura No.1).
Paralelamente, para profundizar en el estudio de los macrófagos se han desarrollado diversos protocolos para el aislamiento y cultivo de macrófagos primarios tanto de ratón como de humano, dado que estos fagocitos, inicialmente reconocidos por su capacidad fagocítica, participan también en procesos fundamentales como la angiogénesis, el remodelado tisular y la eliminación de células apoptóticas, mostrando propiedades tanto proinflamatorias como antiinflamatorias (12,13,14); de hecho, su implicación en el crecimiento tumoral ha incrementado el interés por comprender sus múltiples funciones (12), de modo que en modelos murinos se utiliza el aislamiento a partir de la médula ósea, mientras que en humanos se obtienen a partir de monocitos de sangre periférica (12,13); cabe destacar que entre las técnicas empleadas se encuentran el conteo directo de células, la cuantificación de ADN, la identificación inmunohistoquímica y el análisis del estado proliferativo mediante inmunofluorescencia, metodologías que permiten estudiar la diferenciación de los macrófagos a través del receptor del factor estimulante de colonias 1, cuyo aumento de expresión acompaña la transición de monoblastos a macrófagos maduros (11,12,13,14,15), lo cual se ilustra en la Figura No.2; además, la sepsis humana y el síndrome de activación de macrófagos (MALS) han impulsado el desarrollo de nuevas estrategias terapéuticas, puesto que este síndrome se caracteriza por la activación incontrolada de los macrófagos y la liberación masiva de mediadores inflamatorios, lo que empeora el pronóstico de la sepsis y hace crucial su detección temprana; en este sentido, los criterios diagnósticos más reconocidos son los establecidos por HLH-2004 (2007) y el HScore (2014), los cuales identifican signos de disfunción orgánica múltiple, tales como la elevación de ferritina, alteraciones en la coagulación y trombocitopenia (8,9,10) (Ver Figura No.3); de igual forma, se han investigado nuevos dianas terapéuticas como el receptor GPR37, dado que diversos estudios han demostrado que su activación en macrófagos, mediante moléculas como la neuroprotectina D1 (NPD1) y el artesunato (ARU), mejora la capacidad fagocítica, reduce la inflamación y facilita la resolución del dolor asociado a las infecciones (20,21,22), aspecto que se ilustra en la Figura No.4.
En modelos experimentales se ha observado que ARU actúa tanto sobre parásitos como en la eliminación de eritrocitos infectados, incrementando la supervivencia y atenuando la inflamación sistémica en sepsis bacteriana o inducida por lipopolisacáridos (20,22,23); a nivel molecular, aunque los mecanismos exactos de interacción entre ARU y GPR37 aún no están completamente esclarecidos, se sabe que este receptor activa vías intracelulares como ERK y AKT, que están implicadas en la reparación tisular y la resolución de la inflamación, y además, la identificación de sitios específicos de unión facilita el desarrollo de nuevos fármacos (20,22) (Ver Figura No.5).
Otra innovación terapéutica relevante es la tecnología de macrófagos gelificados intracelularmente, la cual ofrece una plataforma prometedora para el manejo de enfermedades inflamatorias crónicas y autoinmunes, dado que estos macrófagos modificados mantienen la integridad y fluidez de sus componentes, lo que les permite interactuar eficazmente con diversas citoquinas y neutralizar los efectos adversos de la inflamación (26,28,29); además, estos macrófagos funcionan como portadores celulares que liberan medicamentos de forma focalizada, optimizando el tratamiento y minimizando efectos secundarios, y su estabilidad a temperatura ambiente los hace viables tanto en entornos clínicos como en zonas remotas, aunque persisten desafíos como la aprobación regulatoria y la obtención suficiente de células humanas (26,27,28) (Ver Figura No.6); en cuanto a las implicaciones en enfermedades autoinmunes y los protocolos de cultivo, se ha evidenciado que los macrófagos son actores fundamentales del sistema inmunológico innato, puesto que, aunque tradicionalmente estas patologías se han asociado al sistema adaptativo, los macrófagos participan activamente en la modulación de la inflamación, en la atracción de otras células inmunes y en la reparación tisular (30,31,32,33); por ejemplo, en el lupus eritematoso sistémico (LES) estos fagocitos influyen en la activación de linfocitos B mediante la expresión elevada de CD40L, lo que estimula la producción descontrolada de anticuerpos, y además, bajo la influencia de interferones tipo alfa, pueden diferenciarse en células dendríticas que presentan autoantígenos, intensificando la enfermedad (30,35,36,37,38); de igual modo, en la artritis reumatoide (AR) se observa la infiltración característica de macrófagos en el tejido sinovial, y se han identificado subpoblaciones, tales como aquellas que expresan MerTK y TREM2, asociadas con la resolución de la inflamación, aunque la disminución de estas subpoblaciones se relaciona con un mayor riesgo de recaída, lo que sugiere que su manipulación podría representar una estrategia terapéutica innovadora, mientras que biomarcadores como la quimiocina CCL5 se estudian además como herramientas diagnósticas y objetivos terapéuticos (30,39,40,41,42,43).
Asimismo, en la esclerosis sistémica (ES), en la cual se observa fibrosis y daño multisistémico, los macrófagos adoptan perfiles funcionales complejos, y aunque inicialmente se pensó en una polarización hacia un fenotipo M2, investigaciones recientes revelan una combinación de características M1 y M2, lo que podría explicar tanto la progresión de la fibrosis como las alteraciones inmunológicas, destacándose la elevada expresión de SPP1 en macrófagos pulmonares como factor profibrótico (30,44,45,46,47,48).
Estos hallazgos se complementan con avanzados protocolos de aislamiento y cultivo de macrófagos primarios, implementados tanto en ratones (a partir de la médula ósea) como en humanos (a partir de monocitos de sangre periférica), pues los métodos que incluyen el conteo directo de células, la medición de ADN, la identificación inmunohistoquímica y el análisis del estado proliferativo mediante inmunofluorescencia han permitido reproducir fenotipos específicos y analizar la diferenciación mediante marcadores clave como el receptor del factor estimulante de colonias 1, cuya expresión aumenta desde los monoblastos hasta alcanzar niveles elevados en las células progenitoras adherentes (11,12,13,14,15), lo cual es crucial para explorar estrategias terapéuticas que modulen la actividad de los macrófagos y mejoren el manejo de procesos patológicos tales como la aterosclerosis, el cáncer y diversas enfermedades autoinmunes (2,3,5,13,14,15,26,27,28,29,49,50).
A partir de los estudios revisados se evidencia que la inflamación desencadena una cascada molecular compleja en la que neutrófilos, linfocitos y macrófagos interactúan con mediadores como citoquinas y quimiocinas (1–6), y que los macrófagos, además de eliminar patógenos, actúan como reguladores esenciales al modular la respuesta inmunitaria de acuerdo con su polarización en fenotipos M1 o M2, siendo la vía IL-17, a través de sus receptores IL-17RA/RC, un mecanismo clave que influye en la migración celular y la activación de células T, aspectos fundamentales en el desarrollo de diversas patologías, incluidas aquellas de índole autoinmune y cardiovascular; en paralelo, se han implementado estrategias experimentales avanzadas que abarcan desde el aislamiento y cultivo de macrófagos primarios hasta intervenciones terapéuticas innovadoras, tales como la modulación del receptor GPR37 y la tecnología de macrófagos gelificados, enfoques que no solo abren nuevas perspectivas para el tratamiento de la sepsis y condiciones crónicas, sino que también señalan lagunas en la literatura, particularmente en cuanto a la reproducibilidad y validación clínica (2,3,5,6,8,9,30,39,40,49,50).
DISCUSIÓN:
Los hallazgos obtenidos en esta revisión evidencian que la vía IL-17 juega un papel decisivo en la activación de células T y en la migración de macrófagos, lo que a su vez modula su polarización hacia fenotipos M1 o M2. En consecuencia, estos mecanismos moleculares resultan fundamentales para comprender cómo se establece y se mantiene la respuesta inflamatoria, y por ende, para explicar el desarrollo de enfermedades autoinmunes, cardiovasculares y del cáncer (1,2,3,4,5,6). Además, la modulación del receptor GPR37 y la tecnología de macrófagos gelificados emergen como innovaciones terapéuticas prometedoras, ofreciendo nuevas perspectivas en el tratamiento de condiciones crónicas y de sepsis, lo que subraya la importancia de integrar estos avances en la práctica clínica.
Por otro lado, es relevante reflexionar sobre las limitaciones presentes tanto en los estudios revisados como en la propia revisión. En primer lugar, la heterogeneidad en los diseños experimentales y en los modelos utilizados dificulta la comparación directa entre investigaciones, lo que podría sesgar la interpretación de algunos hallazgos. Asimismo, la mayoría de los estudios se basan en modelos animales, lo que limita la extrapolación de resultados a la fisiología humana. Sin embargo, a pesar de estas limitaciones, la consistencia de los datos respalda la relevancia del eje IL-17 en la regulación inmunitaria.
Asimismo, es necesario resaltar la conexión entre los resultados actuales y las preguntas futuras que se plantean. Por ejemplo, ¿cómo se pueden estandarizar los protocolos de aislamiento y cultivo de macrófagos para mejorar la reproducibilidad de los resultados? ¿Qué mecanismos subyacentes vinculan de forma precisa la activación de IL-17 con la migración celular en diferentes contextos patológicos? Estas interrogantes abren un campo de investigación muy interesante, en el que la realización de ensayos clínicos robustos será crucial para validar las estrategias terapéuticas emergentes.
En términos prácticos y teóricos, los avances identificados tienen implicaciones significativas para el diseño de terapias personalizadas. La integración de técnicas de modulación de receptores y tecnologías celulares innovadoras podría transformar el abordaje terapéutico de enfermedades crónicas, permitiendo intervenciones más precisas y menos invasivas. En suma, aunque existen desafíos metodológicos y limitaciones inherentes, la revisión ofrece una perspectiva alentadora que fomenta la continuidad de la investigación en esta área, impulsando un mayor entendimiento del complejo entramado inmunológico y sus aplicaciones clínicas.
DISCUSSION:
The findings of this review clearly indicate that the IL-17 pathway plays a decisive role in T cell activation and macrophage migration, thereby modulating their polarization into either M1 or M2 phenotypes. Consequently, these molecular mechanisms are fundamental for understanding how the inflammatory response is established and maintained, which in turn explains the development of autoimmune disorders, cardiovascular diseases, and cancer (1,2,3,4,5,6). Moreover, the modulation of the GPR37 receptor and the emerging technology of gelated macrophages present promising therapeutic innovations, offering novel perspectives for the treatment of chronic conditions and sepsis, thereby underscoring the need to integrate these advances into clinical practice.
At the same time, it is essential to reflect on the limitations present in both the reviewed studies and the review itself. First, the heterogeneity in experimental designs and the variety of models used complicates direct comparisons between investigations, potentially biasing the interpretation of some findings. Additionally, the reliance on animal models limits the extrapolation of results to human physiology. Nevertheless, despite these challenges, the consistency of the data supports the relevance of the IL-17 axis in immune regulation.
Furthermore, the connection between the current findings and future research questions is evident. For example, how can macrophage isolation and culture protocols be standardized to improve reproducibility? What precise mechanisms link IL-17 activation with cellular migration in various pathological contexts? These questions open a fascinating field of research, where robust clinical trials will be crucial for validating emerging therapeutic strategies.
From both a practical and theoretical standpoint, the advances identified have significant implications for the design of personalized therapies. The integration of receptor modulation techniques and innovative cellular technologies has the potential to transform therapeutic approaches for chronic diseases, enabling interventions that are both more precise and less invasive. Overall, despite methodological challenges and inherent limitations, this review offers an encouraging perspective that supports continued research in this area. It not only contributes to the current body of knowledge but also lays the groundwork for future investigations aimed at translating these insights into effective, targeted therapies.
CONCLUSIONES:
La revisión ha demostrado que la inflamación, al ser un proceso esencial para la defensa del organismo, adquiere un carácter dual cuando se desregula, dando lugar a condiciones crónicas y a diversas patologías, incluidas las autoinmunes y cardiovasculares. La evidencia recopilada destaca el papel crítico de los macrófagos, particularmente a través de la señalización mediada por IL-17, en la modulación de la respuesta inmunitaria, lo que influye en la activación de células T y en la migración celular. Además, la identificación de estrategias terapéuticas innovadoras, como la modulación del receptor GPR37 y la tecnología de macrófagos gelificados, abre nuevas perspectivas para el tratamiento de la sepsis y otras condiciones crónicas.
Estos resultados responden a las preguntas clave planteadas en la introducción, confirmando la importancia del eje IL-17 en la fisiopatología de la inflamación y resaltando el potencial de los macrófagos como blancos terapéuticos. Sin embargo, es imprescindible reconocer las limitaciones de la revisión, principalmente en cuanto a la heterogeneidad metodológica y la dependencia de modelos experimentales animales.
A partir de lo anterior, se sugiere que futuras investigaciones se centren en la estandarización de protocolos de cultivo y aislamiento de macrófagos, así como en la realización de ensayos clínicos que permitan validar los hallazgos en poblaciones humanas. Además, se recomienda explorar con mayor profundidad los mecanismos moleculares que vinculan la señalización de IL-17 con la polarización y migración de macrófagos, lo cual podría conducir al desarrollo de terapias más específicas y personalizadas. En definitiva, estas conclusiones proporcionan una base sólida para futuras aplicaciones clínicas y teóricas en el campo de la inmunología y la terapéutica antiinflamatoria.
CONCLUSIONS:
In summary, this review demonstrates that while inflammation is a fundamental process for defending the organism, its dysregulation leads to chronic conditions and a variety of pathologies, including autoimmune and cardiovascular diseases. The evidence clearly highlights the critical role of macrophages, particularly through IL-17-mediated signaling, in modulating immune responses by influencing T cell activation and cellular migration. In addition, the identification of innovative therapeutic strategies, such as the modulation of the GPR37 receptor and the application of gelated macrophage technology, opens new avenues for the treatment of sepsis and other chronic conditions.
These findings address the key questions posed in the introduction by confirming the significance of the IL-17 axis in the pathophysiology of inflammation and by emphasizing the potential of macrophages as therapeutic targets. However, it is essential to acknowledge the limitations of this review, including methodological heterogeneity and the predominance of animal model data, which may constrain direct clinical translation.
Therefore, future research should focus on standardizing macrophage isolation and culture protocols, and on conducting rigorous clinical trials to validate these findings in human populations. Further investigation into the molecular mechanisms linking IL-17 signaling with macrophage polarization and migration is also warranted. Such efforts will likely lead to the development of more specific and personalized therapeutic interventions, thereby providing a robust foundation for both clinical applications and theoretical advancements in immunology and anti-inflammatory therapeutics.
PUBLICACIÓN
Este artículo no ha sido presentado en forma de comunicación oral o escrita en ningún congreso o jornada científica.
FINANCIACIÓN:
Los autores declaran que no recibieron apoyo financiero para la realización de la investigación ni para la publicación del presente artículo.
DERECHOS Y PERMISOS:
Se han gestionado las reimpresiones y permisos correspondientes con la revista SANUM científico-sanitaria.
CONFLICTO DE INTERESES:
Los autores manifiestan que la investigación se llevó a cabo sin vínculos comerciales o financieros que pudieran interpretarse como un posible conflicto de intereses.
DECLARACIÓN SOBRE INTELIGENCIA ARTIFICIAL GENERATIVA:
Los autores declaran que NO se utilizó ninguna herramienta de inteligencia artificial generativa durante la concepción, redacción, análisis o edición de este manuscrito. Todo el contenido, incluyendo el desarrollo conceptual, la estructura editorial y la redacción final, fue elaborado exclusivamente por los autores humanos. Esta declaración se realiza en cumplimiento con las directrices establecidas por Nature, Elsevier, Springer, ICMJE y COPE.
DECLARACIÓN DE CONTRIBUCIONES DE AUTORÍA
TOZB: Conceptualización general del manuscrito, integración de enfoques clínicos y neuroinmunológicos, análisis del eje IL-17 en enfermedades autoinmunes, supervisión académica y revisión final del documento.
JACL: Búsqueda bibliográfica especializada, curación de datos, redacción del borrador original, análisis de mecanismos inmunológicos de inflamación crónica, edición y estructuración del manuscrito.
FLGC: Revisión crítica de literatura clínica, integración de fuentes sobre terapias emergentes, apoyo en análisis comparativo de modelos inflamatorios y edición técnica del manuscrito.
BIBLIOGRAFÍA:
- Barin JG, Baldeviano GC, Talor MV, Wu L, Ong S, Quader F, Chen P, Zheng D, Caturegli P, Rose NR, Ciháková D. Macrophages participate in IL-17-mediated inflammation. Eur J Immunol. 2012 Mar;42(3):726-36. doi: 10.1002/eji.201141737. Epub 2012 Jan 23. PMID: 22161142; PMCID: PMC4292791.
- Korn T, Oukka M, Kuchroo V, Bettelli E. Th17 cells: effector T cells with inflammatory properties. Semin Immunol. 2007 Dec;19(6):362-71. doi: 10.1016/j.smim.2007.10.007. Epub 2007 Nov 26. PMID: 18035554; PMCID: PMC2839934.
- Yamamoto Y, Klein TW, Friedman H. Involvement of mannose receptor in cytokine interleukin-1beta (IL-1beta), IL-6, and granulocyte-macrophage colony-stimulating factor responses, but not in chemokine macrophage inflammatory protein 1beta (MIP-1beta), MIP-2, and KC responses, caused by attachment of Candida albicans to macrophages. Infect Immun. 1997 Mar;65(3):1077-82. doi: 10.1128/IAI.65.3.1077-1082.1997. PMID: 9038318; PMCID: PMC175090.
- McHugh SL, Yamamoto Y, Klein TW, Friedman H. Murine macrophages differentially produce proinflammatory cytokines after infection with virulent vs. avirulent Legionella pneumophila. J Leukoc Biol. 2000 Jun;67(6):863-8. doi: 10.1002/jlb.67.6.863. PMID: 10857860.
- Chen G, Jiang H, Yao Y, Tao Z, Chen W, Huang F, Chen X. Macrophage, a potential targeted therapeutic immune cell for cardiomyopathy. Front Cell Dev Biol. 2022 Sep 30;10:908790. doi: 10.3389/fcell.2022.908790. PMID: 36247005; PMCID: PMC9561843.
- Hu S, Yang M, Huang S, Zhong S, Zhang Q, Ding H, Xiong X, Hu Z, Yang Y. Different Roles of Resident and Non-resident Macrophages in Cardiac Fibrosis. Front Cardiovasc Med. 2022 Mar 7;9:818188. doi: 10.3389/fcvm.2022.818188. PMID: 35330948; PMCID: PMC8940216.
- Masztalerz, A., Van Rooijen, N., Den Otter, W. et al. Mechanisms of macrophage cytotoxicity in IL-2 and IL-12 mediated tumour regression. Cancer Immunol Immunother 52, 235–242 (2003). https://doi.org/10.1007/s00262-003-0381-z
- Chen, S., Zhang, C., Luo, J. et al. Macrophage activation syndrome in Sepsis: from pathogenesis to clinical management. Inflamm. Res. 73, 2179–2197 (2024). https://doi.org/10.1007/s00011-024-01957-7
- Mills, K.H.G. IL-17 and IL-17-producing cells in protection versus pathology. Nat Rev Immunol 23, 38–54 (2023). https://doi.org/10.1038/s41577-022-00746-9
- Jannini-Sá, Y.A.P., Creyns, B., Hogaboam, C.M., Parks, W.C., Hohmann, M.S. (2024). Macrophages in Lung Repair and Fibrosis. In: Kloc, M., Kubiak, J.Z., Halasa, M. (eds) Monocytes and Macrophages in Development, Regeneration, and Disease. Results and Problems in Cell Differentiation, vol 74. Springer, Cham. https://doi.org/10.1007/978-3-031-65944-7_10
- Giamarellos-Bourboulis, E.J., Netea, M.G. (2020). Macrophage Activation Syndrome in Sepsis: Does It Exist and How to Recognize It?. In: Vincent, JL. (eds) Annual Update in Intensive Care and Emergency Medicine 2020. Annual Update in Intensive Care and Emergency Medicine. Springer, Cham. https://doi.org/10.1007/978-3-030-37323-8_21
- Chitu V, Yeung YG, Yu W, Nandi S, Stanley ER. Measurement of macrophage growth and differentiation. Curr Protoc Immunol. 2011 Feb;Chapter 14:Unit 14.20.1-26. doi: 10.1002/0471142735.im1420s92. PMID: 21400680; PMCID: PMC4184440.
- de Juan, A., Lavin Plaza, B. (2022). Isolation and Culturing of Primary Mouse and Human Macrophages. In: Ramji, D. (eds) Atherosclerosis. Methods in Molecular Biology, vol 2419. Humana, New York, NY. https://doi.org/10.1007/978-1-0716-1924-7_7
- Perdiguero EG, Geissmann F. The development and maintenance of resident macrophages. Nat Immunol. 2016 Jan;17(1):2-8. doi: 10.1038/ni.3341. PMID: 26681456; PMCID: PMC4950995.
- Lee DS, Oh K. Cancer Stem Cells in the Immune Microenvironment. Adv Exp Med Biol. 2021;1187:245-266. doi: 10.1007/978-981-32-9620-6_12. PMID: 33983582.
- Vergadi E, Kolliniati O, Lapi I, Ieronymaki E, Lyroni K, Alexaki VI, Diamantaki E, Vaporidi K, Hatzidaki E, Papadaki HA, Galanakis E, Hajishengallis G, Chavakis T, Tsatsanis C. An IL-10/DEL-1 axis supports granulopoiesis and survival from sepsis in early life. Nat Commun. 2024 Jan 23;15(1):680. doi: 10.1038/s41467-023-44178-y. PMID: 38263289; PMCID: PMC10805706.
- Buschmann K, Tschada R, Metzger MS, Braach N, Kuss N, Hudalla H, Poeschl J, Frommhold D. RAGE controls leukocyte adhesion in preterm and term infants. BMC Immunol. 2014 Nov 27;15:53. doi: 10.1186/s12865-014-0053-0. PMID: 25428166; PMCID: PMC4256735.
- Bracho F, Goldman S, Cairo MS. Potential use of granulocyte colon-stimulating factor and granulocyte-macrophage colony-stimulating factor in neonates. Curr Opin Hematol. 1998 May;5(3):215-20. doi: 10.1097/00062752-199805000-00012. PMID: 9664163.
- Cuenca AG, Cuenca AL, Gentile LF, Efron PA, Islam S, Moldawer LL, Kays DW, Larson SD. Delayed emergency myelopoiesis following polymicrobial sepsis in neonates. Innate Immun. 2015 May;21(4):386-91. doi: 10.1177/1753425914542445. Epub 2014 Aug 7. PMID: 25106654; PMCID: PMC4320686.
- Bang S, Donnelly CR, Luo X, Toro-Moreno M, Tao X, Wang Z, Chandra S, Bortsov AV, Derbyshire ER, Ji RR. Activation of GPR37 in macrophages confers protection against infection-induced sepsis and pain-like behaviour in mice. Nat Commun. 2021 Mar 17;12(1):1704. doi: 10.1038/s41467-021-21940-8. PMID: 33731716; PMCID: PMC7969930.
- Wang J, Xu C, Liao FL, Jiang T, Krishna S, Tu Y. A Temporizing Solution to «Artemisinin Resistance». N Engl J Med. 2019 May 30;380(22):2087-2089. doi: 10.1056/NEJMp1901233. Epub 2019 Apr 24. PMID: 31018065.
- Blasco B, Leroy D, Fidock DA. Antimalarial drug resistance: linking Plasmodium falciparum parasite biology to the clinic. Nat Med. 2017 Aug 4;23(8):917-928. doi: 10.1038/nm.4381. PMID: 28777791; PMCID: PMC5747363.
- An J, Minie M, Sasaki T, Woodward JJ, Elkon KB. Antimalarial Drugs as Immune Modulators: New Mechanisms for Old Drugs. Annu Rev Med. 2017 Jan 14;68:317-330. doi: 10.1146/annurev-med-043015-123453. Epub 2016 Oct 21. PMID: 27813878.
- Miranda AS, Brant F, Rocha NP, Cisalpino D, Rodrigues DH, Souza DG, Machado FS, Rachid MA, Teixeira AL Jr, Campos AC. Further evidence for an anti-inflammatory role of artesunate in experimental cerebral malaria. Malar J. 2013 Nov 2;12:388. doi: 10.1186/1475-2875-12-388. PMID: 24180288; PMCID: PMC3827003.
- Yang Z, Ding J, Yang C, Gao Y, Li X, Chen X, Peng Y, Fang J, Xiao S. Immunomodulatory and anti-inflammatory properties of artesunate in experimental colitis. Curr Med Chem. 2012;19(26):4541-51. doi: 10.2174/092986712803251575. PMID: 22834815.
- Gao, C., Wang, Q., Ding, Y. et al. Targeted therapies of inflammatory diseases with intracellularly gelated macrophages in mice and rats. Nat Commun 15, 328 (2024). https://doi.org/10.1038/s41467-023-44662-5
- Esteban-Fernández de Ávila B, Angsantikul P, Ramírez-Herrera DE, Soto F, Teymourian H, Dehaini D, Chen Y, Zhang L, Wang J. Hybrid biomembrane-functionalized nanorobots for concurrent removal of pathogenic bacteria and toxins. Sci Robot. 2018 May 30;3(18):eaat0485. doi: 10.1126/scirobotics.aat0485. PMID: 33141704.
- Zhang Q, Zhou J, Zhou J, Fang RH, Gao W, Zhang L. Lure-and-kill macrophage nanoparticles alleviate the severity of experimental acute pancreatitis. Nat Commun. 2021 Jul 6;12(1):4136. doi: 10.1038/s41467-021-24447-4. PMID: 34230486; PMCID: PMC8260623.
- Lu H, Wu L, Liu L, Ruan Q, Zhang X, Hong W, Wu S, Jin G, Bai Y. Quercetin ameliorates kidney injury and fibrosis by modulating M1/M2 macrophage polarization. Biochem Pharmacol. 2018 Aug;154:203-212. doi: 10.1016/j.bcp.2018.05.007. Epub 2018 May 16. Erratum in: Biochem Pharmacol. 2022 Apr;198:114936. doi: 10.1016/j.bcp.2022.114936. PMID: 29753749.
- Yang S, Zhao M, Jia S. Macrophage: Key player in the pathogenesis of autoimmune diseases. Front Immunol. 2023 Feb 14;14:1080310. doi: 10.3389/fimmu.2023.1080310. PMID: 36865559; PMCID: PMC9974150.
- Kaul A, Gordon C, Crow MK, Touma Z, Urowitz MB, van Vollenhoven R, Ruiz-Irastorza G, Hughes G. Systemic lupus erythematosus. Nat Rev Dis Primers. 2016 Jun 16;2:16039. doi: 10.1038/nrdp.2016.39. PMID: 27306639.
- Katsiari CG, Liossis SN, Sfikakis PP. The pathophysiologic role of monocytes and macrophages in systemic lupus erythematosus: a reappraisal. Semin Arthritis Rheum. 2010 Jun;39(6):491-503. doi: 10.1016/j.semarthrit.2008.11.002. Epub 2009 Jan 15. PMID: 19147182.
- Ma WT, Gao F, Gu K, Chen DK. The Role of Monocytes and Macrophages in Autoimmune Diseases: A Comprehensive Review. Front Immunol. 2019 May 24;10:1140. doi: 10.3389/fimmu.2019.01140. PMID: 31178867; PMCID: PMC6543461.
- Chalmers SA, Chitu V, Herlitz LC, Sahu R, Stanley ER, Putterman C. Macrophage depletion ameliorates nephritis induced by pathogenic antibodies. J Autoimmun. 2015 Feb;57:42-52. doi: 10.1016/j.jaut.2014.11.007. Epub 2014 Dec 29. PMID: 25554644; PMCID: PMC4323927.
- Ameer MA, Chaudhry H, Mushtaq J, Khan OS, Babar M, Hashim T, Zeb S, Tariq MA, Patlolla SR, Ali J, Hashim SN, Hashim S. An Overview of Systemic Lupus Erythematosus (SLE) Pathogenesis, Classification, and Management. Cureus. 2022 Oct 15;14(10):e30330. doi: 10.7759/cureus.30330. PMID: 36407159; PMCID: PMC9662848.
- Herrada AA, Escobedo N, Iruretagoyena M, Valenzuela RA, Burgos PI, Cuitino L, Llanos C. Innate Immune Cells’ Contribution to Systemic Lupus Erythematosus. Front Immunol. 2019 Apr 15;10:772. doi: 10.3389/fimmu.2019.00772. PMID: 31037070; PMCID: PMC6476281.
- Pan L, Lu MP, Wang JH, Xu M, Yang SR. Immunological pathogenesis and treatment of systemic lupus erythematosus. World J Pediatr. 2020 Feb;16(1):19-30. doi: 10.1007/s12519-019-00229-3. Epub 2019 Feb 22. PMID: 30796732; PMCID: PMC7040062.
- Squatrito, D., Emmi, G., Silvestri, E. et al. Pathogenesis and potential therapeutic targets in systemic lupus erythematosus: from bench to bedside. Autoimmun Highlights 5, 33–45 (2014). https://doi.org/10.1007/s13317-014-0058-y
- Kinne RW, Bräuer R, Stuhlmüller B, Palombo-Kinne E, Burmester GR. Macrophages in rheumatoid arthritis. Arthritis Res. 2000;2(3):189-202. doi: 10.1186/ar86. Epub 2000 Apr 12. PMID: 11094428; PMCID: PMC130001.
- Kurowska-Stolarska, M., Alivernini, S. Synovial tissue macrophages in joint homeostasis, rheumatoid arthritis and disease remission. Nat Rev Rheumatol 18, 384–397 (2022). https://doi.org/10.1038/s41584-022-00790-8
- Yoon BR, Yoo SJ, Choi Yh, Chung YH, Kim J, Yoo IS, Kang SW, Lee WW. Functional phenotype of synovial monocytes modulating inflammatory T-cell responses in rheumatoid arthritis (RA). PLoS One. 2014 Oct 17;9(10):e109775. doi: 10.1371/journal.pone.0109775. PMID: 25329467; PMCID: PMC4201467.
- Yanni G, Whelan A, Feighery C, Bresnihan B. Synovial tissue macrophages and joint erosion in rheumatoid arthritis. Ann Rheum Dis. 1994 Jan;53(1):39-44. doi: 10.1136/ard.53.1.39. PMID: 8311554; PMCID: PMC1005241.
- Patterson AM, Schmutz C, Davis S, Gardner L, Ashton BA, Middleton J. Differential binding of chemokines to macrophages and neutrophils in the human inflamed synovium. Arthritis Res. 2002;4(3):209-14. doi: 10.1186/ar408. Epub 2002 Jan 31. PMID: 12010572; PMCID: PMC111024.
- Guiducci S, Giacomelli R, Cerinic MM. Vascular complications of scleroderma. Autoimmun Rev. 2007 Sep;6(8):520-3. doi: 10.1016/j.autrev.2006.12.006. Epub 2007 Jan 12. PMID: 17854742.
- Toledo DM, Pioli PA. Macrophages in Systemic Sclerosis: Novel Insights and Therapeutic Implications. Curr Rheumatol Rep. 2019 May 23;21(7):31. doi: 10.1007/s11926-019-0831-z. PMID: 31123840; PMCID: PMC7444604.
- van Hal TW, van Bon L, Radstake TR. A system out of breath: how hypoxia possibly contributes to the pathogenesis of systemic sclerosis. Int J Rheumatol. 2011;2011:824972. doi: 10.1155/2011/824972. Epub 2011 Nov 20. PMID: 22162692; PMCID: PMC3228323.
- Kräling BM, Maul GG, Jimenez SA. Mononuclear cellular infiltrates in clinically involved skin from patients with systemic sclerosis of recent onset predominantly consist of monocytes/macrophages. Pathobiology. 1995;63(1):48-56. doi: 10.1159/000163933. PMID: 7546275.
- Ballerie A, Lescoat A, Augagneur Y, Lelong M, Morzadec C, Cazalets C, Jouneau S, Fardel O, Vernhet L, Jégo P, Lecureur V. Efferocytosis capacities of blood monocyte-derived macrophages in systemic sclerosis. Immunol Cell Biol. 2019 Mar;97(3):340-347. doi: 10.1111/imcb.12217. Epub 2018 Dec 13. PMID: 30426551.
- van Furth R, Cohn ZA, Hirsch JG, Humphrey JH, Spector WG, Langevoort HL. The mononuclear phagocyte system: a new classification of macrophages, monocytes, and their precursor cells. Bull World Health Organ. 1972;46(6):845-52. PMID: 4538544; PMCID: PMC2480884.
- Ginhoux F, Guilliams M. Tissue-Resident Macrophage Ontogeny and Homeostasis. Immunity. 2016 Mar 15;44(3):439-449. doi: 10.1016/j.immuni.2016.02.024. PMID: 26982352.
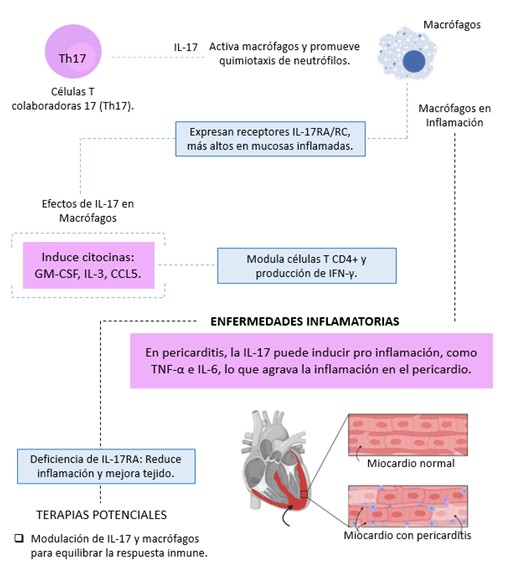
Figura No.1. IL-17 es una citoquina clave producida por las células T colaboradoras 17 (Th17), esencial en la inflamación crónica y enfermedades autoinmunes. Los receptores IL-17RA/RC, expresados en macrófagos, regulan su activación en respuesta a entornos inflamatorios, desempeñando un papel dinámico según su ubicación anatómica y estado de activación. Estos hallazgos, respaldados por estudios experimentales y modelos murinos, destacan la importancia de IL-17 en la inmunidad innata y adaptativa, así como su impacto en enfermedades inflamatorias cardíacas y autoinmunes. La modulación del eje IL-17-macrófagos se perfila como una estrategia terapéutica prometedora para restaurar el equilibrio inmunológico y tratar enfermedades inflamatorias crónicas. (Elaboración propia de los autores, basada en la revisión exhaustiva de la literatura citada en el manuscrito) Referencias adaptadas (2,3,6).
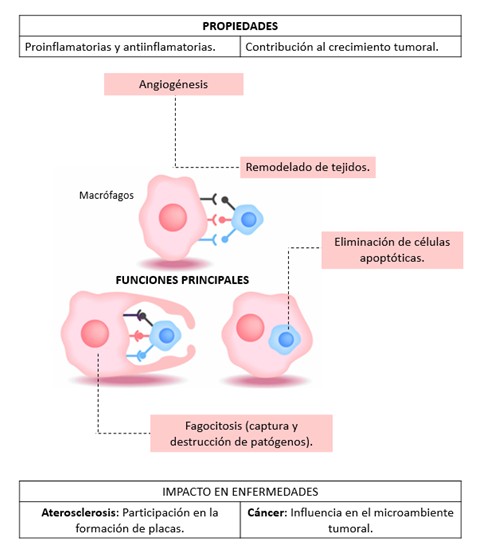
Figura No.2. Los macrófagos son células multifuncionales esenciales en la inmunidad innata, con roles que van más allá de la fagocitosis, incluyendo la remodelación tisular y la regulación de procesos inflamatorios. Su estudio en modelos animales y humanos ha permitido avanzar en la comprensión de su biología y su impacto en enfermedades inflamatorias, cardiovasculares y oncológicas. Las técnicas actuales de aislamiento, cultivo y caracterización son herramientas fundamentales para explorar nuevas estrategias terapéuticas basadas en la modulación de su actividad y fenotipo. (Elaboración propia de los autores, basada en la revisión exhaustiva de la literatura citada en el manuscrito) Referencias adaptadas (11,12,15).
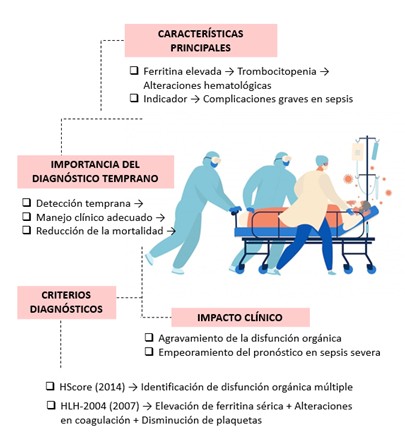
Figura No.3. El Síndrome de Activación de Macrófagos (MALS) en sepsis es un proceso crítico caracterizado por la hiperactivación de macrófagos y la liberación descontrolada de mediadores inflamatorios. Los criterios HLH-2004 y HScore son herramientas diagnósticas fundamentales para su identificación, destacando marcadores como la ferritina sérica elevada y la trombocitopenia. La detección temprana de MALS es esencial para implementar estrategias terapéuticas que mejoren el pronóstico de los pacientes. (Elaboración propia de los autores, basada en la revisión exhaustiva de la literatura citada en el manuscrito) Referencias adaptadas (8,9,10).
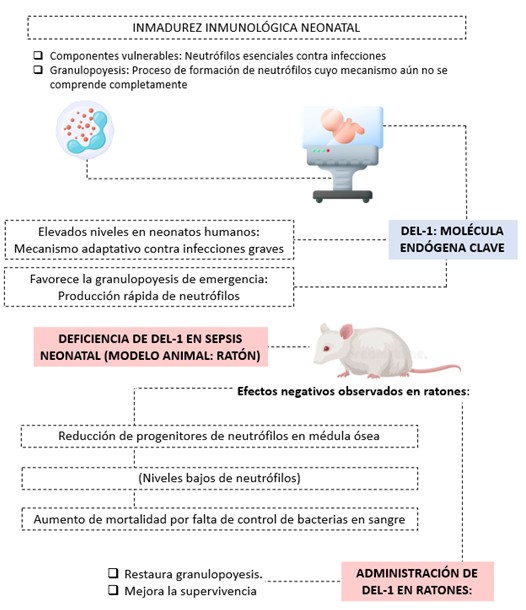
Figura No.4: La inmadurez inmunológica neonatal afecta la función de los neutrófilos, cruciales para defender contra infecciones. DEL-1, una molécula clave, se encuentra elevada en neonatos humanos, ayudando a la producción de neutrófilos en situaciones de emergencia. En ratones, la deficiencia de DEL-1 durante la sepsis provoca neutropenia, reducción de progenitores en la médula ósea y mayor mortalidad. La administración de DEL-1 restaura la granulopoyesis y mejora la supervivencia. Además, citoquinas como IL-10 estimulan la producción de DEL-1, mientras que IL-17A la inhibe. Estos hallazgos destacan el papel de DEL-1 en la protección neonatal y su potencial terapéutico para mejorar la supervivencia en sepsis. (Elaboración propia de los autores, basada en la revisión exhaustiva de la literatura citada en el manuscrito) Referencias adaptadas (16,17,18,19).
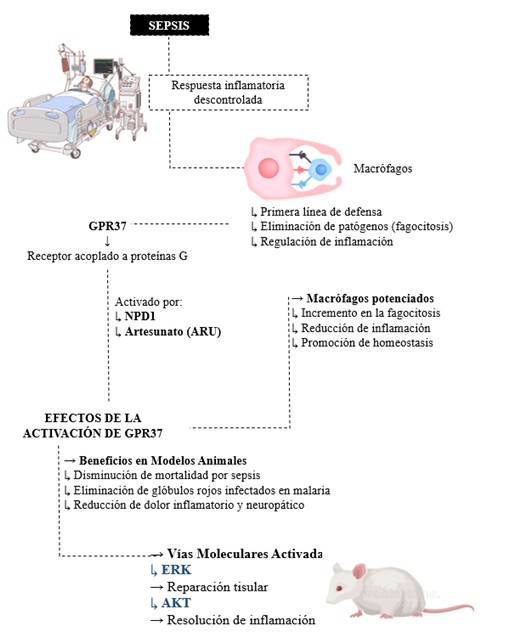
Figura No.5. El receptor GPR37 en macrófagos juega un papel crucial en la sepsis al potenciar la fagocitosis, reducir la inflamación y aliviar el dolor postinfección, abriendo nuevas oportunidades terapéuticas en enfermedades infecciosas y crónicas. (Elaboración propia de los autores, basada en la revisión exhaustiva de la literatura citada en el manuscrito) Referencias adaptadas (20,21).
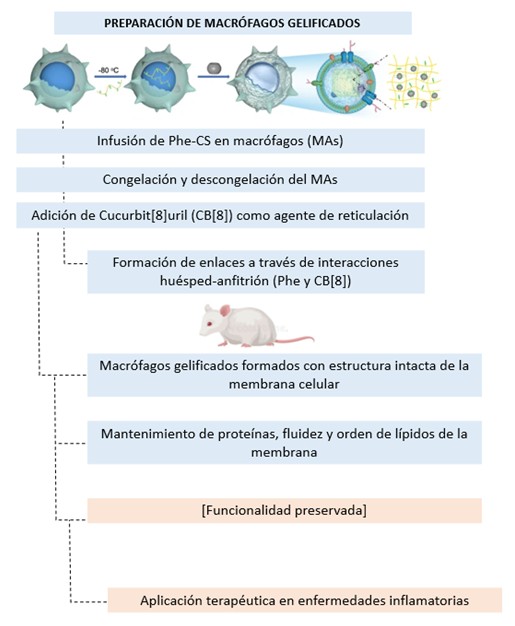
Figura No.6. La tecnología de macrófagos gelificados intracelularmente se basa en un proceso innovador que comienza con la infusión de fenilalanina-graftada quitosa (Phe-CS) en macrófagos (MAs). Estos son sometidos a un ciclo de congelación y descongelación, preparándolos para la adición de Cucurbit[8]uril (CB[8]), un agente de reticulación que facilita la formación de enlaces específicos mediante interacciones huésped-anfitrión entre la fenilalanina y el CB[8]. Como resultado, se generan macrófagos gelificados con membranas celulares completamente intactas, manteniendo sus proteínas esenciales, fluidez y orden lipídico, lo que asegura su funcionalidad preservada. Esta tecnología tiene aplicaciones prometedoras en el tratamiento de enfermedades inflamatorias, particularmente en artritis reumatoide y neumonía aguda. En el caso de la artritis reumatoide, los macrófagos gelificados, tras infiltrarse localmente en la pata inflamada de modelos animales, neutralizan citoquinas inflamatorias, alivian los daños articulares y son efectivos tanto en aplicaciones preventivas como terapéuticas. Además, su capacidad de cargar diclofenaco sódico intracelularmente optimiza la respuesta antiinflamatoria. Por otro lado, en el tratamiento de la neumonía aguda, los macrófagos gelificados administrados por vía intravenosa se acumulan de manera dirigida en los pulmones inflamados, donde reducen la inflamación y, gracias a la carga intracelular de quercetina, potencian su acción terapéutica. Esta tecnología no solo ofrece una solución innovadora y eficaz para tratar diversas afecciones inflamatorias, sino que también destaca por su capacidad de preservar la funcionalidad celular y su flexibilidad para incorporar fármacos, posicionándose como una herramienta transformadora en el ámbito de la medicina moderna. (Elaboración propia de los autores, basada en la revisión exhaustiva de la literatura citada en el manuscrito) Referencias adaptadas (26,27).

