
Complemento, plaquetas y netosis: microinflamación silente en VIH virorreprimido
Complement, platelets and netosis: silent microinflammation in virorepressed HIV
[Artículo en español / Article in Spanish]
Vol. 10 Núm. 1. Noviembre 2025 - Enero 2026.
e-ISSN: 2530-5468 - Open Access Journal
DOI: 10.5281/zenodo.18184237
Published under Creative Commons CC BY-NC-ND 4.0
Sanum. vol. 10, número 1 (2026) páginas 114 – 119
AUTORES:
Zaida Mercedes Miranda May. Universidad de Antioquia, Medellín, Colombia. ORCID: https://orcid.org/0000-0002-3403-1919.
Brayan Ricardo Mosquera Arias. Universidad Santiago de Cali, Programa de Medicina Cali; Valle del Cauca, Colombia. ORCID: https://orcid.org/0009-00091628-9316.
Como citar este artículo:
Miranda-May ZM, Mosquera-Arias BR. Complemento, plaquetas y netosis: microinflamación silente en VIH virorreprimido. SANUM 2026, 10(1) pp 8 – 16 DOI: 10.5281/zenodo.18184237
© Los autores. Publicado por SANUM: Revista Científico-Sanitaria bajo una licencia Creative Commons Atribución-NoComercial-SinDerivadas 4.0 Internacional (CC BY-NC-ND 4.0). ![]()
How to cite this article:
Miranda-May ZM, Mosquera-Arias BR. Complement, platelets and netosis: silent microinflammation in virorepressed HIV. SANUM 2026, 10(1) pp 8 – 16 DOI: 10.5281/zenodo.18184237
© The authors. Published by SANUM: Revista Científico-Sanitaria under a Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0). ![]()
Tipo de artículo: caso clínico.
Sección: Medicina Interna, Inmunología clínica.
Fecha recepción: 06-12-2025.
Fecha aceptación: 16-01-2026.
Fecha publicación: 29-01-2026.
RESUMEN
La persistencia de inflamación inmunometabólica en personas que viven con VIH virorreprimido constituye un desafío clínico emergente, asociado a mayor carga de comorbilidades no definitorias de SIDA y riesgo cardiovascular precoz. El objetivo de esta revisión y reporte de caso es analizar el papel fisiopatológico del eje complemento–plaquetas–NETosis (C2–C5a/C5aR–CD62P–NETs) en la activación inmunotrombótica subclínica y su relevancia diagnóstica y terapéutica. Se realizó una búsqueda narrativa estructurada no sistemática en PubMed, Scopus y Web of Science, incluyendo estudios experimentales, observacionales y ensayos clínicos publicados entre 2017–2025 sobre inflamación residual, inmunotrombosis y biomarcadores del complemento en VIH controlado. Los principales hallazgos indican que, incluso bajo supresión virológica sostenida, persiste disregulación del complemento con disminución de C2 y aumento de C5a, acompañada de activación plaquetaria (CD62P-MFI) e inducción de NETosis, mecanismos que favorecen microtrombosis endotelial y enfermedad cardiovascular silenciosa.
El caso clínico presentado ejemplifica la relevancia de estos hallazgos y la necesidad de evaluación inmunológica ampliada ante síntomas inespecíficos. Se concluye destacando el potencial clínico de biomarcadores inmunotrombóticos para estratificación individualizada y de terapias dirigidas al eje C5a/C5aR.
PALABRAS CLAVE:
Proteínas de Complemento;
Plaquetas;
Riesgo cardiovascular;
VIH;
Thromboinflammation.
ABSTRACT:
Persistent immunometabolic inflammation in virally suppressed people living with HIV (PLWH) represents an emerging clinical challenge linked to increased non-AIDS comorbidities and early cardiovascular risk. This review and case report aim to analyze the physiological role of the complement–platelet–NETosis axis (C2–C5a/C5aR–CD62P–NETs) in subclinical immunothrombotic activation and their diagnostic and therapeutic implications. A structured narrative search was conducted in PubMed, Scopus, and Web of Science, including experimental, observational, and clinical trial evidence published between 2017–2025 related to residual inflammation, immunothrombosis, and complement biomarkers in controlled HIV. Findings indicate that, despite sustained viral suppression, persistent complement dysregulation occurs with decreased C2 and elevated C5a, along with platelet activation (CD62P-MFI) and NETosis induction, promoting endothelial microthrombosis and silent cardiovascular disease.
The presented case illustrates the clinical relevance of these mechanisms and supports expanded immunologic evaluation in PLWH with nonspecific symptoms. We conclude by highlighting the potential value of immunothrombotic biomarkers for personalized risk stratification and targeted C5a/C5aR therapeutic strategies.
KEYWORDS:
Complement System Proteins;
Blood Platelets;
Heart Disease Risk Factors;
HIV;
Immunothrombosis.
INTRODUCCIÓN:
La persistencia de inflamación inmunometabólica en personas que viven con infección por virus de la inmunodeficiencia humana (VIH) bajo supresión virológica sostenida representa un desafío clínico creciente. Aunque la terapia antirretroviral moderna ha reducido drásticamente la morbimortalidad asociada a SIDA, diversos estudios demuestran disregulación persistente del sistema del complemento, activación plaquetaria subclínica e inducción de NETosis, mecanismos que favorecen inmunotrombosis y enfermedad cardiovascular temprana, hoy principales causas de complicaciones en pacientes virorreprimidos (1,2,3). Esta revisión analiza la relevancia fisiopatológica del eje C2–C5a/C5aR–NETosis, su impacto clínico y sus posibles aplicaciones diagnósticas y terapéuticas. Se abordan preguntas clave: ¿cómo se manifiesta esta inflamación silenciosa en pacientes virorreprimidos?, ¿qué biomarcadores permiten detectarla precozmente?, ¿pueden las intervenciones dirigidas modificar el riesgo cardiovascular?.
PRESENTACIÓN DE CASO:
Paciente, hombre de 54 años, profesor universitario, residente en Alemania y actualmente en seguimiento médico en Colombia durante periodo vacacional, diagnosticado con infección por virus de la inmunodeficiencia humana (VIH) hace 16 años, en terapia antirretroviral combinada con bictegravir/emtricitabina/tenofovir alafenamida y con adherencia óptima, manteniendo carga viral indetectable de forma sostenida durante los últimos 9 años. Consulta al servicio de medicina interna por fatiga progresiva, dolor torácico opresivo atípico no relacionado con el esfuerzo, y aparición intermitente de manchas violáceas en muslos asociadas a calambres en miembros inferiores desde hace cuatro meses.
Refiere disminución progresiva de su capacidad física con sensación de “pesadez corporal” y episodios transitorios de palpitaciones sin síncope ni disnea. Niega fiebre, pérdida de peso, tos, consumo actual de tabaco u otras sustancias psicoactivas. Antecedentes personales: dislipidemia en prevención primaria y tabaquismo suspendido hace diez años. Examen físico: tensión arterial (TA) 126/78 mmHg, frecuencia cardíaca (FC) 82 latidos por minuto, saturación periférica de oxígeno (SatO₂) 98% en aire ambiente (AA), índice de masa corporal (IMC) 27 kg/m²; evaluación cardiovascular y pulmonar sin alteraciones, presencia de livedo reticularis tenue en muslos, pulsos periféricos conservados y sin signos de trombosis venosa.
Laboratorios iniciales: proteína C reactiva (PCR) 4.8 mg/L, fibrinógeno 470 mg/dL, dímero-D 610 ng/mL, lipoproteínas de baja densidad (LDL) 152 mg/dL; troponina negativa, electrocardiograma sin cambios isquémicos y ecocardiograma normal. Ante síntomas subcrónicos y perfil inflamatorio discretamente elevado en paciente virorreprimido, se amplió estudio inmunológico identificándose disminución del componente 2 del complemento (C2), elevación marcada de anaphylotoxina C5a (C5a), aumento de la expresión plaquetaria de P-selectina, medida como intensidad media de fluorescencia (CD62P-MFI), y aumento de marcadores de NETosis (formación de trampas extracelulares de neutrófilos, NETs por Neutrophil Extracellular Traps), con correlación positiva entre mieloperoxidasa (MPO) y C5a. Se concluyó disregulación del complemento con activación inflamatorio-trombótica persistente e inducción de NETosis en persona con VIH virorreprimido, dentro del espectro de comorbilidades no definitorias de SIDA (NACM) y enfermedad cardiovascular subclínica precoz.
Se instauró manejo con prevención cardiovascular intensificada (estatinas de alta potencia, dieta mediterránea, ejercicio antiinflamatorio progresivo), control metabólico estricto, suspensión definitiva del tabaco y seguimiento conjunto inmunología–cardiología, considerando en evolución futuras terapias dirigidas al eje C5a/C5aR (receptor de C5a). Además, se implementó plan reno-metabólico preventivo: se inició inhibidor de transportadores renales de sodio-glucosa tipo 2 (SGLT2), dapagliflozina 10 mg/día, por protección cardiorrenal; se añadió espironolactona 25 mg/día como antifibrótico microvascular y ácido eicosapentaenoico (EPA) 4 g/día; se ajustó la dislipidemia con rosuvastatina 20 mg/día y aspirina 81 mg/día como antiagregante, más vitamina D3 4000 UI/día, hidratación estructurada y control metabólico trimestral.
DIAGNÓSTICO:
Disregulación del complemento con C2 disminuido y C5a elevado, activación plaquetaria CD62P-dependiente y NETosis asociada en paciente VIH virorreprimido (1,2,3).
DISCUSIÓN:
Los hallazgos del estudio de Subia et al. aportan evidencia sólida de que, incluso bajo supresión virológica efectiva en personas que viven con VIH (PLWH, People Living With HIV) (1,2), persiste una disregulación del sistema del complemento, acompañada de activación inmunotrombótica mediada por el eje C5a/C5aR (fragmento anafilotoxina C5a y su receptor de superficie C5a-Receptor) (1,3).
Esta alteración se manifiesta por la reducción significativa de C2 (componente 2 del complemento) y el aumento de C5a, así como por la intensa activación plaquetaria evidenciada por el incremento en la expresión de CD62P-MFI (Mean Fluorescence Intensity de P-selectina plaquetaria) (1,4,5).
En conjunto, estos resultados revelan una inflamación residual clínicamente silenciosa, capaz de inducir NETosis (formación de trampas extracelulares de neutrófilos, NETs por Neutrophil Extracellular Traps), fenómeno clave en la progresión hacia inmunotrombosis y enfermedad cardiovascular subclínica, tal como sugieren estudios previos sobre comorbilidades no definitorias de SIDA (NACM, Non-AIDS Comorbidities) (1,4,5)
El trabajo demuestra que el plasma de PLWH induce NETosis de manera dependiente del eje C5a/C5aR, y que el bloqueo experimental de dicho receptor reduce de forma significativa la formación de NET. Esto concuerda con mecanismos descritos previamente en modelos de sepsis y COVID-19 (1,3), donde la activación del complemento, la activación plaquetaria y la inflamación neutrofílica convergen para desencadenar daño endotelial y trombosis microvascular (1).
Entre las limitaciones reconocidas se incluyen: tamaño muestral reducido, representación clínica limitada de PLWH con mayor carga de NACM y evaluación parcial de la cascada del complemento al no incluir fragmentos como iC3b o C3dg. Se destaca también la necesidad de explorar la expresión celular de C5aR en diferentes subpoblaciones inmunitarias y el rol potencial de coinfección por citomegalovirus (CMV) (1,4,5).
Estos resultados plantean futuras líneas de investigación como estudios longitudinales que evalúen la capacidad predictiva de C5a, CD62P y NETosis en eventos cardiovasculares y ensayos clínicos con inhibidores de C5a/C5aR como estrategia terapéutica. En la práctica clínica, se refuerza la urgencia de estratificación inmunometabólica personalizada en PLWH virorreprimidos) (1,4,5). Ver Figura 1.
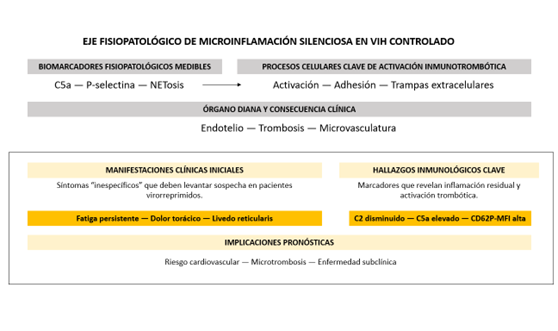
Figura 1. Modelo fisiopatológico que integra síntomas clínicos, biomarcadores inmunológicos y consecuencias pronósticas en un paciente con infección por virus de la inmunodeficiencia humana (VIH) virorreprimido. La activación persistente del complemento (C2 disminuido, C5a elevado), la activación plaquetaria (CD62P-MFI) y la formación de trampas extracelulares de neutrófilos (NETosis) convergen hacia inmunotrombosis y enfermedad cardiovascular subclínica pese a supresión virológica sostenida. (Autoría propia de los autores).
Figure 1. Pathophysiological model integrating clinical symptoms, immunological biomarkers, and prognostic consequences in a virologically suppressed patient with human immunodeficiency virus (HIV) infection. Persistent complement activation (decreased C2, elevated C5a), platelet activation (CD62P-MFI), and neutrophil extracellular trap formation (NETosis) converge toward immunothrombosis and subclinical cardiovascular disease despite sustained virological suppression. (Authors’ own work).
DISCUSSION:
The findings of Subia et al. provide robust evidence that, even under effective virologic suppression in people living with HIV (PLWH) (1,2), dysregulation of the complement system persists, accompanied by immunothrombotic activation mediated by the C5a/C5aR axis (the anaphylatoxin fragment C5a and its surface receptor, C5a receptor) (1,3).
This disturbance is characterized by a significant reduction in C2 (complement component 2) and an increase in C5a, together with marked platelet activation evidenced by increased CD62P mean fluorescence intensity (MFI) of platelet P-selectin (1,4,5).
Taken together, these results reveal a clinically silent residual inflammatory state capable of inducing NETosis (formation of neutrophil extracellular traps, NETs), a key mechanism in the progression toward immunothrombosis and subclinical cardiovascular disease, as suggested by previous studies on non-AIDS comorbidities (NACM) (1,4,5).
The study demonstrates that plasma from PLWH induces NETosis in a C5a/C5aR-dependent manner, and that experimental blockade of this receptor significantly reduces NET formation. This is consistent with mechanisms previously described in sepsis and COVID-19 models (1,3), where complement activation, platelet activation, and neutrophilic inflammation converge to drive endothelial injury and microvascular thrombosis (1).
Recognized limitations include a small sample size, limited clinical representation of PLWH with a higher burden of NACM, and partial assessment of the complement cascade, as fragments such as iC3b or C3dg were not evaluated. The need to explore cellular expression of C5aR across different immune subpopulations and the potential role of cytomegalovirus (CMV) coinfection is also highlighted (1,4,5).
These findings open future research avenues, including longitudinal studies assessing the predictive value of C5a, CD62P, and NETosis for cardiovascular events, as well as clinical trials testing C5a/C5aR inhibitors as a therapeutic strategy. From a clinical standpoint, the results reinforce the urgency of personalized immunometabolic stratification in virologically suppressed PLWH (1,4,5). See Figure 1.
CONCLUSIÓN:
Este caso clínico evidencia que, incluso bajo supresión virológica prolongada y con adecuada recuperación inmunológica cuantitativa, las personas que viven con VIH pueden presentar inflamación residual inmunometabólica asociada a disregulación del complemento, activación plaquetaria subclínica y NETosis inducida (1,2,3), fenómenos que contribuyen de manera determinante al desarrollo de comorbilidades no definitorias de SIDA y particularmente enfermedad cardiovascular precoz) (1,4,5).
La identificación temprana de C2 disminuido, C5a elevado, aumento de CD62P-MFI y marcadores de NETosis resalta la necesidad de evaluaciones inmunológicas más profundas en pacientes virorreprimidos con síntomas que antes se habrían considerado inespecíficos. El caso responde preguntas clave planteadas en la introducción al confirmar que la supresión viral no garantiza la resolución completa de la activación inmunitaria ni la normalización de la coagulación-inflamación endotelial.
Estos hallazgos subrayan la importancia de un abordaje preventivo integral que combine intervención cardiometabólica agresiva, estrategias antiinflamatorias y vigilancia interdisciplinaria. Futuras investigaciones deben explorar terapias dirigidas al eje C5a/C5aR, el impacto longitudinal del control metabólico intensivo y el valor clínico de la monitorización rutinaria de NETosis y biomarcadores del complemento como predictores de riesgo vascular en VIH controlado) (1,4,5).
CONCLUSION
This clinical case demonstrates that, even under prolonged virologic suppression with adequate quantitative immune recovery, people living with HIV may exhibit residual immunometabolic inflammation associated with complement dysregulation, subclinical platelet activation, and induced NETosis (1,2,3). These phenomena contribute decisively to the development of non-AIDS-defining comorbidities, particularly premature cardiovascular disease (1,4,5).
Early identification of reduced C2 levels, elevated C5a, increased CD62P-MFI, and markers of NETosis underscores the need for deeper immunological assessments in virologically suppressed patients presenting with symptoms previously considered nonspecific. This case addresses key questions raised in the introduction by confirming that viral suppression alone does not ensure complete resolution of immune activation or normalization of the endothelial coagulation–inflammation axis.
These findings highlight the importance of a comprehensive preventive approach combining aggressive cardiometabolic intervention, anti-inflammatory strategies, and interdisciplinary surveillance. Future research should explore therapies targeting the C5a/C5aR axis, the longitudinal impact of intensive metabolic control, and the clinical value of routine monitoring of NETosis and complement biomarkers as predictors of vascular risk in controlled HIV infection (1,4,5).
DECLARACIÓN DE TRANSPARENCIA:
Los autores declaran que el presente manuscrito es un trabajo original, elaborado de forma honesta y transparente. El contenido no ha sido publicado previamente, ni total ni parcialmente, ni se encuentra sometido a evaluación en ninguna otra revista o medio científico.
CONSENTIMIENTO INFORMADO:
Se obtuvo el consentimiento informado por escrito del paciente para acceso a historia clínica e información.
FINANCIACIÓN:
Los autores declaran que no recibieron apoyo financiero para la realización de la investigación ni para la publicación de este artículo.
CONFLICTOS DE INTERÉS:
Los autores manifiestan no tener relaciones comerciales o financieras que pudieran constituir un potencial conflicto de interés.
PUBLICACIÓN
Este trabajo no ha sido presentado ni publicado previamente en ninguna otra revista científica, congreso, jornada, medio académico o plataforma de difusión.
CONTRIBUCIÓN DE LOS AUTORES:
Los autores han contribuido de manera equitativa a la concepción, redacción, análisis crítico y aprobación final del manuscrito. Asumen plena responsabilidad por el contenido y las conclusiones del trabajo.
USO DE IA GENERATIVA:
Los autores confirman que no se empleó inteligencia artificial generativa en la preparación de este manuscrito.
BIBLIOGRAFÍA:
- Natalie T Subia, Thomas K Awamura, Logan S Dean, Keona Loftis, Louie Mar Gangcuangco, Iain MacPherson, Sandra Chang, Dominic C Chow, Cecilia M Shikuma, Juwon Park, Dysregulation of complement components associated with inflammation and coagulation in virally suppressed people living with HIV, The Journal of Immunology, Volume 214, Issue 11, November 2025, Pages 2871–2880, https://doi.org/10.1093/jimmun/vkaf227
- Park J, Dean LS, Heckl J, Gangcuangco LM, Pedro TK, Tallquist MD, Seto TB, Shiramizu B, Chow DC, Shikuma CM. Low-density granulocytes display immature cells with enhanced NET formation in people living with HIV. Sci Rep. 2023 Aug 16;13(1):13282. doi: 10.1038/s41598-023-40475-0. PMID: 37587169; PMCID: PMC10432506.
- Collins LF, Palella FJ Jr, Mehta CC, Holloway J, Stosor V, Lake JE, Brown TT, Topper EF, Naggie S, Anastos K, Taylor TN, Kassaye S, French AL, Adimora AA, Fischl MA, Kempf MC, Koletar SL, Tien PC, Ofotokun I, Sheth AN. Aging-Related Comorbidity Burden Among Women and Men With or At-Risk for HIV in the US, 2008-2019. JAMA Netw Open. 2023 Aug 1;6(8):e2327584. doi: 10.1001/jamanetworkopen.2023.27584. PMID: 37548977; PMCID: PMC10407688.
- Coss SL, Zhou D, Chua GT, Aziz RA, Hoffman RP, Wu YL, Ardoin SP, Atkinson JP, Yu CY. The complement system and human autoimmune diseases. J Autoimmun. 2023 May;137:102979. doi: 10.1016/j.jaut.2022.102979. Epub 2022 Dec 18. PMID: 36535812; PMCID: PMC10276174.
- Raposo MA, Armiliato GNA, Guimarães NS, Caram CA, Silveira RDS, Tupinambás U. Metabolic disorders and cardiovascular risk in people living with HIV/AIDS without the use of antiretroviral therapy. Rev Soc Bras Med Trop. 2017 Sep-Oct;50(5):598-606. doi: 10.1590/0037-8682-0258-2017. PMID: 29160505.

