Tweet
La gestación es un periodo de riesgo para la portadora de hemofilia que requiere un manejo adecuado en la Unidad de Alto Riesgo Obstétrico. Durante la gestación se producen una serie de cambios en la hemostasia que causan una tendencia procoagulante en la mujer.
Los objetivos a destacar serán adquirir los conocimientos necesarios para atender a la mujer hemofílica en el embarazo, parto y período de postparto, optimizar el manejo integral de la mujer con hemofilia mediante recomendaciones basadas en la mejor evidencia científica disponible y describir el papel de la matrona y el plan de actuación para atender a la mujer en el embarazo, parto y periodo de postparto.
Se ha realizado una revisión bibliográfica en manuales de obstetricia, documentos de consenso, guías de práctica clínica, protocolos y material on line en las bases de datos: Cuiden, Pubmed, Scielo y biblioteca Cochrane, durante los últimos 10 años.
La totalidad de estudios valorados coinciden en realizar recomendaciones en el manejo durante el embarazo, manejo durante el parto, manejo durante el período de posparto y manejo del recién nacido.
Como conclusión es importante que las matronas basemos nuestra práctica profesional en la mejor evidencia científica existente para asegurar unos cuidados materno-fetales de calidad. La gestación, el parto y puerperio son períodos de riesgo en la portadora de hemofilia que requieren un manejo adecuado por todos los profesionales que la atiendan.
Summary
Pregnancy is a risk period in the hemophilia patient that requires adequate management in the Obstetric High Risk Unit. During pregnancy there are any changes in hemostasis that cause a procoagulant tendency in women. The aims to be highlighted will be to acquire the necessary knowledge to attend the hemophilia women in pregnancy, delivery and postpartum period, to optimize the integral management of women with hemophilia through recommendations based on the best available scientific evidence and describe the role of the midwife and the plan of action to care for women in pregnancy, derivery and postpartum period.
A bibliographic review has been made in obstetrical manuals, consensus documents, clinical practice guidelines, protocols and online material in the databases: Cuiden, Pubmed, Scielo and Cochrane Library, during the last 10 years.
All the evaluated studies coincide in making recommendations in the management during the pregnancy, management during the delivery, management during the period of postpartum and management of the newborn.
As a conclusion, it is important that midwives base our professional practice on the best scientific evidence to ensure quality maternal-fetal care. Pregnancy, delivery and puerperium are periods of risk in the hemophilia carrier that require adequate management by all professionals who attend it.
PALABRAS CLAVE:
Hemofilia
Embarazo
Parto
Matronas
KEYWORDS:
Hemophilia
Pregnancy
Parturition
Midwives
INTRODUCCIÓN
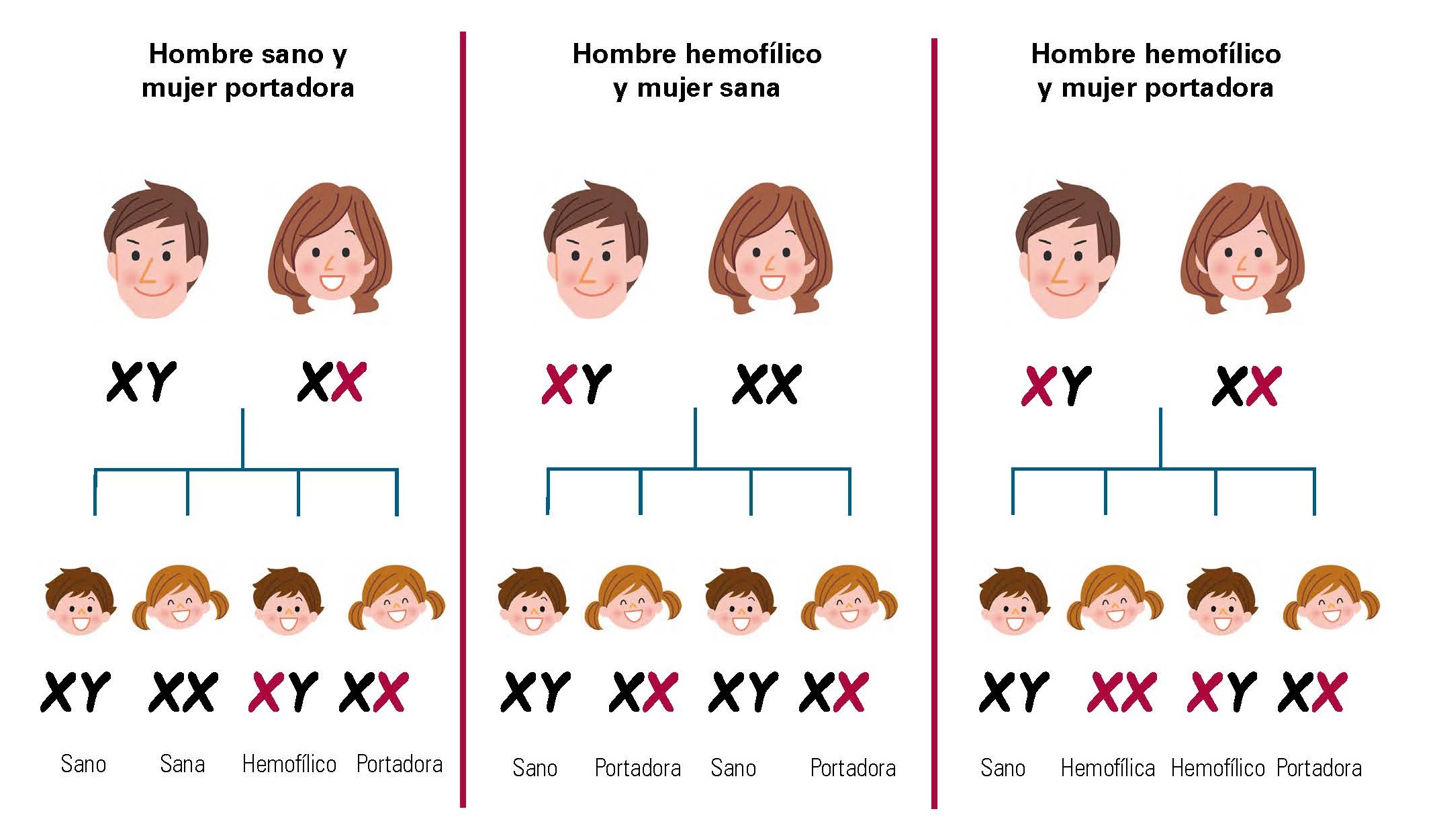
La hemofilia es una enfermedad hemorrágica congénita cuya transmisión está ligada al sexo. El gen responsable se localiza en el cromosoma X; las mujeres (XX) son portadoras de la enfermedad y los varones (XY) los afectados por la misma. La sangre de las personas con hemofilia no coagula normalmente porque carecen o tienen disminuido alguno de los factores de la coagulación.
En la sangre hay doce factores coagulantes, cuando el deficiente es el factor ocho (FVIII) se denomina hemofilia A y cuando es el factor nueve (FIX), hemofilia B. La primera es diez veces más frecuente que la segunda. Se estima que la frecuencia es de 1 por cada 10.000 nacimientos en la hemofilia A. Se ha descrito que en un 70% de los casos existen antecedentes familiares y en un 30% son el resultado de nuevas mutaciones genéticas aunque este porcentaje se está modificando con las nuevas técnicas de reproducción asistida que permiten una selección de sexo.
Los dos síntomas mayores de la hemofilia son hemorragia externa prolongada, y hematomas que ocurren con facilidad o sin razón aparente.
Los varones tienen un solo cromosoma X (genotipo XY) siempre procedente de la madre, mientras que las mujeres tienen 2 cromosomas X, uno de origen paterno y otro de origen materno (genotipo XX). Por esta razón, un varón que reciba de su madre un cromosoma X con el gen F8 o F9 alterados, tendrá una producción reducida o nula de la proteína correspondiente (factor VIII o factor IX), por lo que padecerá la enfermedad. Una mujer, sin embargo, aunque herede de uno de sus progenitores un cromosoma X con el gen F8 o F9 alterados, tendrá el gen normal en el otro cromosoma X que producirá el factor correspondiente haciendo que la mujer presente menos síntomas hemorrágicos y que no padezca hemofilia.
Así pues, el concepto de portadora es aquella mujer que tiene la alteración genética pero que no padece la sintomatología de la enfermedad aunque puede transmitirla a su descendencia.
Según la herencia clásica ligada al cromosoma X, un paciente hemofílico varón (XhY) no tendrá hijos varones afectados ya que heredan el cromosoma Y normal de su padre, mientras que todas sus hijas serán obligatoriamente portadoras porque heredan el Xh del padre con la mutación responsable de la hemofilia.
Una mujer portadora (XhX) tendrá un riesgo, en cada embarazo, del 25% de concebir un hijo varón afectado (hemofílico) y otro 25% de concebir una hija portadora; el 50% de probabilidad restante será de tener un hijo o hija no afectados. Por último, en teoría, una mujer puede ser hemofílica si su padre es hemofílico y su madre portadora.
El tratamiento de la hemofilia consiste en la administración del factor deficitario; éste puede ser de origen plasmático o recombinante.
Estos presentan la misma eficacia clínica que los productos plasmáticos sin riesgo teórico de transmisión de enfermedades virales conocidas, pero su costo es mayor. Ambos productos desarrollan inhibidores de FAH. El tratamiento sustitutivo con el factor se puede realizar de forma profiláctica o sólo cuando se produce hemorragia. Debe administrarse siempre por vía intravenosa y la dosis depende de los niveles basales y de los niveles necesarios para alcanzar una buena hemostasia para la indicación del tratamiento.
El objetivo del presente artículo es describir mediante una revisión bibliográfica las características clínicas en mujeres con hemofilia durante el embarazo, parto y puerperio, curso clínico y resultados perinatales.
CONTENIDOS
Embarazo en mujeres portadoras
La planificación familiar en aquellas mujeres portadoras de hemofilia debe ser considerada por la pareja en conjunto después de haber recibido un consejo genético adecuado y toda la información disponible, ya que decisiones unilaterales pueden conducir a problemas psicológicos. Dentro del consejo genético la pareja debe ser informada de las técnicas actualmente disponibles.
Si la pareja decide un embarazo normal se dispone de un diagnóstico, no invasivo, del sexo del feto que se realiza con una extracción de sangre materna entre la séptima y la novena semana de gestación. Si fuera un varón se podría hacer diagnóstico prenatal que consiste en la obtención de vellosidades coriónicas por vía trans-abdominal entre la 11ª y la 13ª semana de gestación con lo que se tendría la certeza de si el futuro niño puede o no padecer la enfermedad. Otra opción es el diagnóstico genético preimplantacional con todas las dificultades inherentes a esta técnica.
El seguimiento del embarazo y del parto de una portadora de hemofilia debe ser llevado a cabo en conjunto por el ginecólogo y el hematólogo si hay afectación o se desconoce si puede haberla. Para la decisión de parto por vía vaginal o cesárea no hay criterios en la literatura sobre que es mejor.
Si se sabe que es una niña y la madre es una portadora con niveles normales de FVIII o FIX, el embarazo se puede seguir solo por el ginecólogo, exceptuando las portadoras con valores moderados bajos en cuyo caso puede ser necesaria la utilización de desmopresina o de concentrados de factores de la coagulación.
Manejo de la gestación en mujeres portadoras de hemofilia.
Durante la gestación se producen una serie de cambios en la hemostasia que causan una tendencia procoagulante en la mujer. Algunos de ellos son la elevación en los niveles en plasma de los factores de la coagulación VII, VIII, X, XII, FvW y fibrinógeno.
No sufren modificaciones los factores II, V, IX y XI. Por otra parte, disminuyen su actividad plasmática el factor XIII, el activador tisular del plasminógeno y la proteína S. Los niveles de FIX no cambian significativamente por ello es más probable que las portadoras de hemofilia B requieran con mayor probabilidad aporte hemostático si se producen complicaciones hemorrágicas durante el embarazo o en el parto, que las portadoras de hemofilia A. No obstante, también se debe dejar claro que el déficit de FVIII es más hemorrágico que el de FIX.
Estas modificaciones no se producen siempre de igual manera en todas las gestantes e incluso, pueden ser diferentes para cada uno de los distintos embarazos de una misma mujer. Todo revierte a la normalidad tras el parto en unos días o semanas. Estos cambios también se producen en las portadoras de hemofilia y, aunque clásicamente se ha atribuido a las portadoras de hemofilia la ausencia de clínica hemorrágica, esto no es totalmente cierto como se ha mencionado ya en apartados anteriores de estas recomendaciones. Por esta razón, es importante conocer en qué momento de la gestación se producen estos cambios y cuándo ocurre su reversión a la normalidad.
Está documentado que los niveles de factor VIII y FvW van aumentando a partir de la semana 18 de gestación, alcanzando sus máximos niveles entre las 28 y las 35 semanas.
Manejo de la gestación-alumbramiento-puerperio
Situaciones de riesgo
Como ya se ha indicado anteriormente, hay momentos durante el embarazo donde se puede tener un mayor riesgo de hemorragias:
- En el 1er trimestre, por abortos, legrados, diagnóstico prenatal molecular (biopsias, amniocentesis, etc.).
- Entre el 2º y 3er trimestre, en casos de placenta previa, desprendimiento placentario e incluso, en caso de plantearse realizar una cordoncentesis para extraer sangre fetal.
- Final de la gestación (momento del parto), debido al tipo de anestesia aplicada (epidural o general), tipo de parto (vaginal o cesárea).
- Durante el puerperio, en que muchas portadoras sangran más cuando los niveles de factor revierten al nivel basal.
Manejo durante el parto
Naturalmente en el momento del parto, y siempre que sea posible, estas pacientes deben ser atendidas en un centro donde se les pueda prestar atención por parte de un grupo multidisciplinar formado por obstetras, anestesistas, matronas, neonatólogos y hematólogos, con un protocolo de actuación conjunta como referente, analizando cada caso de forma individualizada.
Como ya se ha indicado anteriormente, es conveniente tener documentados los niveles de factor al menos en la semana 28 a 34 y, si fuese posible, realizarlo de nuevo antes del parto lo que facilitará la toma de decisiones y/o adoptar una actitud preventiva.
Independientemente de los niveles de factor de la portadora, el parto puede ser por vía vaginal o mediante cesárea; esta última sólo debería ser indicada por el ginecólogo por causas obstétricas (distocias, gemelaridad, mala dinámica uterina, etc.), y no por el estado de portadora.
La instrumentalización en el parto (ventosas, fórceps, etc.) está contraindicada ya que se pueden originar daños en el posible neonato afectado de hemofilia, y favorecer laceraciones o desgarros vaginales o perineales en la portadora.
En cuanto a la anestesia, deberá ser una decisión tomada conjuntamente entre la propia paciente, el anestesista y el hematólogo, teniendo en cuenta el nivel de factor, la posible coexistencia de otras alteraciones de la hemostasia, las posibilidades de tratamiento y, en todo caso, las preferencias de la paciente portadora.
Así, por ejemplo, ante una anestesia epidural (que conlleva riesgo de hematoma subdural y, en algunos casos, de secuelas neurológicas), habrá situaciones en que se deba proporcionar un tratamiento sustitutivo previo. En cualquier caso, cada situación deberá ser analizada de forma individual por el anestesista y el hematólogo, teniendo en cuenta la opinión de la mujer portadora, previa información de los riesgos y otorgamiento del consentimiento informado.
Los niveles de factor recomendados para un trabajo de parto, alumbramiento y anestesia de forma segura, serán superiores al 50%, tanto para factor VIII como para el factor IX.
Recomendaciones terapéuticas
Como ya se ha comentado, los niveles de factor óptimos para un alumbramiento seguro serán superiores al 50%, en portadoras de hemofilia (tanto A cómo B), con niveles de factor inferiores al 30%, se recomienda tratamiento sustitutivo con concentrado de factor VIII o IX, preferentemente recombinante.
En las portadoras con niveles entre el 30 y el 50% de FIX se repondrá factor, mientras que si dichos niveles son de FVIII se prefiere usar desmopresina (0,3 μg/kg por vía intravenosa o intranasal). Este tratamiento plantea cierta controversia por el riesgo de hiponatremia por retención de agua, por lo que deberá evitarse en las gestantes con preeclampsia y/o cardiopatía.
Las portadoras tienen un mayor riesgo de hemorragia postparto después de su primer alumbramiento, en comparación con las no portadoras, independientemente de las concentraciones de factor de coagulación.
Después del parto las concentraciones de FVIII disminuyen hasta niveles a menudo inferiores a los niveles previos al embarazo. Esta caída fisiológica en la concentración de FVIII puede ser lo suficientemente grave como para provocar hemorragias en mujeres que presentaban concentraciones bajas de FVIII antes del embarazo, pero concentraciones normales de FVIII al término de la gestación.
Manejo del RN inmediato
Se ha de tomar una muestra de cordón de la porción ligada al niño: tubo con citrato, centrifugar y congelar el plasma a -70ºC, y un tubo EDTA. Se hace más difícil el diagnóstico de hemofilia B, o deficiencia del Factor IX, porque el recién nacido normal tiene bajos niveles de actividad de coagulación de todos los factores dependientes de vitamina K.
Se deben evitar las punciones intramusculares y venosas en los recién nacidos (RN) afectados de hemofilia o si se desconoce su estatus de coagulación. La vitamina K debe ser administrada por vía oral y las inmunizaciones deben ser colocadas por vía subcutánea (SC) una vez que se conozca en nivel del factor VIII por si hubiera la necesidad de la administración del factor. Se debe realizar tomografía(TAC)/ultrasonido craneal en todos los RN con sospecha de hemofilia que hayan tenido parto prematuro o traumático (fórceps o trabajo de parto prolongado y laborioso), o si hay signos clínicos sugerentes de hierptensión intracraneal(HIC).
CONCLUSIONES
La planificación familiar en aquellas mujeres portadoras de hemofilia debe ser considerada por la pareja en conjunto después de haber recibido un consejo genético adecuado y toda la información disponible. La gestación es un periodo de riesgo en la portadora de hemofilia que requiere un manejo adecuado en coordinación con la Unidad de Alto Riesgo Obstétrico. El seguimiento del embarazo y del parto de una portadora de hemofilia debe ser llevado a cabo en conjunto por el ginecólogo y el hematólogo y el anestesista si hay afectación o se desconoce si puede haberla.
Es fundamental conocer el sexo del feto para planificar las actuaciones del obstetra y anestesista. Las guías más recientes dicen que no está contraindicado el parto vaginal para un feto varón hemofílico, pero advierte sobre los partos prolongados e instrumentados. La forma óptima de realizar un parto (vaginal o cesárea) tiene que ser individualizada tomando en consideración los riesgos fetales y maternos así como la salud reproductiva futura de la mujer. Existe la necesidad de elaboración de una guía para el manejo de la parturienta hemofílica.
CONCLUSIONS
Birth control in women with hemophilia should be considered by the couple as a whole after adequate genetic counseling and all available information. Pregnancy is a period of risk in the hemophilia carrier that requires adequate management in coordination with the Obstetric High Risk Unit. Follow-up of the pregnancy and delivery of a hemophilia carrier should be carried out jointly by the gynecologist, hematologist, and anesthesiologist if there is any involvement or it is unknown if there may be. It is essential to find out the sex of the fetus to plan the actions of the obstetrician and anesthetist. The most recent guidelines say that vaginal delivery for a male fetus is not contraindicated, but warns about prolonged and instrumented delivery.
The optimal way to perform a delivery (vaginal or cesarean) has to be individualized taking into account the fetal and maternal risks as well as the future reproductive health of the woman. There is a need to develop a guide for the management of hemophilic parturients.
1.- Rezan A. Kadir y Andra H. James Salud reproductiva en mujeres con trastornos de la coagulación.
2.- Medline-Plus.
3.- Eveline P. Mauser-Bunschoten Portadoras de hemofilia sintomáticas. Van Creveldkliniek and Haematology University Medical Centre,Utrecht, Holanda. 2009.
4.- Dra. Carme Altisent Unidad de hemofilia. Hospital Vall d'Hebron Portadoras de hemofilia.¿Qué es necesario saber?. Associació Catalana de l’hemofilia. Fundació Privada Catalana de l’hemofilia.
5.- Villar A. Perspectiva actual del estudio de portadoras de hemofilia. Madrid, Noviembre 2007.
6.- Peyvandi F, y col. Genetic diagnosis of haemophilia and other inherited bleeding disorders. Haemophilia 2006; 12(Suppl 3):82-9.
7.- Demers C, y col. SOGC Clinical Practica Guidelines. Gynaecological and Obstetric Management of Women with inherited Bleeding disorders. J Obstet Gynaecol Can 2005; 27:707-32.
8.- Gringeri A. Congenital bleeding disorders and pregnancy. Haematologica 2005; 1:43-6.
9.- Yang MY, Ragni MV. Clinical manifestations and management of labor and delivery in women with factor IX deficiency. Haemophilia 2004; 10:483-90.
10.- Lee CA, Chi C. The obstetric and Gynecological management of women with inherited blleding disorders. Haemophilia 2006; 12:301-36.
11.- Giangrande PLF. Management of pregnancy in carriers of haemophilia. Haemophilia 1998; 4:779-84.
12.- Chi C, y col. Pregnancy in carriers of haemophilia. Haemophilia 2008; 14:56-64.
13.- Mannucci PM. Use of Desmopressin (DDAVP) during early pregnancy in factor VIII-deficient women. Blood 2005; 105:3382.
14.- Chi C, Kadir RA. Management of women with inherited bleeding disorders in pregnancy. Obstetric & Gynecologist 2007; 9:27-33.
15.- Street AM, y col. Management of carriers and babies with haemophilia. Haemophilia 2008; 14(Suppl 3):181-7.
16.- Guía de Reproducción Humana Asistida en el Sistema Andaluz de Salud. Revisión 2006. Ed. Servicio Andaluz de Salud. Consejería de Salud. Junta de Andalucía.
17.- Liras A, y col. Reproducción asistida. Aplicación en enfermedades hereditarias y serodiscordancia VIH/VHC. Ed. Real Fundación “Victoria Eugenia”, 2004. Madrid.
18.- Hahn S, y col. Recent progress in non-invasive prenatal diagnosis. Semin Fetal Neonatal Med 2008; 13:57-62.
19.- Lavery S. Preimplantation genetic diagnosis: new reproductive options for carriers of haemophilia. Haemophilia 2004; 10(Suppl 4):126-32.
20.- Thornhill AR, y col. European Society of Human Reproduction and Embryology PGD Consortium. Best practice guidelines for clinical preimplantation genetic diagnosis (PGD) and preimplantation genetic screening (PGS). Human Reproduction 2005; 20:35–48.
21.- The obstetric and gynaecological management of women with inherited bleeding disorders review with guidelines produced by a taskforce of UK Haemophilia Centre Doctors Organization. Haemophilia (2006), 12, 301–336.
22. Guía Clínica 2010 hemofilia. Ministerio de Salud de Chile.























