Tweet
Streptococcus agalactiae, denominado habitualmente como Estreptococo del grupo B (EGB), es una de las causas más importantes de infección neonatal precoz.
Actualmente las guías recomiendan la detección del EGB en muestras de exudado vaginal o vagino-rectales de mujeres embarazadas de 35 a 37 semanas de gestación.
El empleo de medios cromogénicos, junto a medios de enriquecimiento, útiles sobre todo en aquellos casos de bajas cargas bacterianas, y el empleo de las nuevas técnicas diagnósticas como la espectrofometría de masas (Maldi-Toff MS) o las técnicas de amplificación de ácidos nucleicos (NAAT). Todas ellas han ayudado a reducir el retraso diagnóstico, así como a mejorar la sensibilidad en la detección precoz del EGB en la mujer gestante, con el fin de administrar adecuadamente la profilaxis antibiótica(5-7).
El objetivo de este estudio fue evaluar el medio cromogénico agar Brilliance™ GBS (Thermo Fisher Scientific™) para la detección de S. agalactiae (EGB) en comparación con otro medio comercial, el Agar Granada (BBLTM).
Abstract
Streptococcus agalactiae, commonly referred to as group B streptococcus (GBS), is one of the most important causes of early neonatal infection. Currently the guidelines recommend the detection of GBS in vaginal exudate or vagino-rectal samples of pregnant women from 35 to 37 weeks of gestation.
The use of chromogenic media, together with enrichment media, useful especially in cases of low bacterial loads, and the use of new diagnostic techniques such as mass spectrometry (Maldi-Toff MS) or nucleic acid amplification techniques (NAAT). All of them have helped to reduce the diagnostic delay, as well as to improve the sensitivity in the early detection of GBS in pregnant women, in order to properly administer antibiotic prophylaxis (5-7).
The aim of this study was to evaluate the chromogenic Brilliance™ GBS (Thermo Fisher Scientific ™) agar medium for the detection of S. agalactiae (GBS) in comparison with another commercial medium, the Granada Agar (BBLTM).
Palabras clave:
Colonización vagino-rectal
Recién Nacido
Medio Brilliance™ GBS
Agar Granada
Maldi-Toff MS.
Keywords:
Vaginal-rectal colonization
Newborn
Medium Brilliance ™ GBS
Granada Agar
Maldi-Toff MS.
INTRODUCCIÓN:
Streptococcus agalactiae, denominado habitualmente como Estreptococo del grupo B (EGB), es una de las causas más importantes de infección neonatal precoz. La incidencia de infección neonatal por EGB oscila entre los 0,80 y 3,06 por cada 1000 nacimientos en los países desarrollados(1, 2).
Las infecciones por Streptococcus beta hemolítico del grupo B que afectan a recién nacidos (RN) menores de 7 días de vida constituyen la causa principal de procesos infecciosos graves y mortales en el periodo neonatal. Las estrategias para evitar la enfermedad por EGB en el neonato se basan en que los recién nacidos que pueden presentar la infección son hijos de madres colonizadas por EGB. Sin embargo, la duración del estado de portador es imprevisible, comprobándose que está presente en el momento del cultivo y parto en el 100%, si no transcurren más de 5 semanas entre ambos.
Streptococcus agalactiae es un coco grampositivo beta-hemolítico —aunque un pequeño porcentaje de cepas (3-5%) no producen hemólisis—, posee una cápsula formada por un polisacárido muy rico en ácido siálico y el tipo de polisacárido capsular permite su clasificación en diferentes serotipos de los que hasta hoy se han identificado 10 (Ia,Ib, II-IX). El polisacárido capsular es un factor de virulencia que le permite evadir los mecanismos de defensa del huésped y su fagocitosis por el sistema inmune. Otro importante factor de virulencia es la producción de hemolisina, que está ligada a la producción de un pigmento característico.
EGB coloniza de forma asintomática el tracto gastrointestinal y la vagina de una alta proporción de adultos sanos. La colonización puede ser transitoria, intermitente o persistente y, tanto en el hombre como en la mujer, el reservorio es el tracto gastrointestinal (recto). La tasa de colonización vaginorrectal por EGB es muy variable. En Europa se han señalado tasas entre el 6,5 y el 36%, con predominio de cifras próximas al 20%. En España se han publicado tasas de colonización en embarazadas del 12 al 20%. Además de infecciones en el RN, EGB es causa de infección en gestantes y puérperas y fuera del periodo perinatal, y en adultos con patología subyacente (diabetes, neoplasias, inmunosupresión).
El RN se coloniza por EGB a su paso por el canal del parto colonizado, intraútero tras la rotura de membranas o, menos frecuentemente, por vía ascendente, aun con las membranas íntegras. Aproximadamente el 50% de los RN de madres portadoras son colonizados por EGB, mientras que solo el 5% de los RN de madres en que EGB no se detecta por cultivo están colonizados. Un elevado grado de colonización vaginal se considera un factor de riesgo de colonización y de infección neonatal precoz. Dado que la colonización vaginal por EGB puede ser intermitente, los cultivos realizados antes del parto no son absolutamente fiables para predecir el estado de portadora en el momento del parto. Por ello, embarazadas que hayan estado colonizadas por EGB en un embarazo anterior pueden no estarlo en el embarazo actual.
En ausencia de medidas de prevención, entre el 1 y el 2% de los RN colonizados durante el parto desarrollan una infección precoz (en los primeros 7 días de vida). Este cuadro cursa como sepsis, neumonía o meningitis, y en la gran mayoría de casos se presenta durante las primeras 24 horas de vida. La mortalidad, que en los años 1970-1980 alcanzaba el 50%, actualmente se ha reducido al 4-5% como resultado de los avances en la asistencia neonatal. Sin embargo, como consecuencia de la infección, el 25-30% de los RN afectados padecen importantes secuelas neurológicas. Además de la colonización materna por EGB, diferentes factores aumentan el riesgo de infección neonatal precoz. Sin embargo, el 50% de las infecciones se presentan en RN sin factores de riesgo.
La infección por EGB después de la primera semana de vida se denomina infección neonatal tardía y se presenta habitualmente como bacteriemia o meningitis. La fuente de contagio de los RN que desarrollan infección tardía no está clara, pudiendo provenir de la madre colonizada o de otras fuentes (personal sanitario, familiares, etc.); más del 50% de RN que desarrollan infección neonatal tardía nacen de madres no colonizadas. La estrategia de prevención basada en la aplicación de profilaxis antibiótica intraparto (PAI) no es efectiva para prevenir la infección neonatal tardía, y actualmente no existe ninguna estrategia que permita su prevención. EGB es, aún hoy, una de las causas más frecuentes de infección bacteriana perinatal en España y en otros países desarrollados. La ausencia de confirmación microbiológica en RN con sepsis clínica puede deberse a los antibióticos administrados a la madre y/o al pequeño volumen de sangre obtenido para realizar hemocultivos en los RN.
El rendimiento de los métodos microbiológicos para la detección del EGB ha mejorado enormemente en los últimos años. El empleo de medios cromogénicos, junto a medios de enriquecimiento, útiles sobre todo en aquellos casos de bajas cargas bacterianas, y el empleo de las nuevas técnicas diagnósticas como la espectrofometría de masas (Maldi-Toff MS) o las técnicas de amplificación de ácidos nucleicos (NAAT). Todas ellas han ayudado a reducir el retraso diagnóstico, así como a mejorar la sensibilidad en la detección precoz del EGB en la mujer gestante, con el fin de administrar adecuadamente la profilaxis antibiótica(5-7).
La elección del medio de cultivo para detectar EGB en escobillones vaginales y/o rectales puede influir de forma importante en la eficacia de esta medida, ya que son diversos los medios de cultivo los que se utilizan para este fin. Actualmente las guías recomiendan la detección del EGB en muestras de exudado vaginal o vagino-rectales de mujeres embarazadas de 35 a 37 semanas de gestación. Siendo la detección de portadoras y la administración de profilaxis antibiótica intraparto el método más eficaz y el más recomendado para prevenir la infección neonatal precoz por EGB(3, 4).
No sería necesario determinar la sensibilidad de EGB frente a beta-lactámicos ya que continúa siendo sensible prácticamente de forma uniforme, aunque recientemente se han descrito cepas con sensibilidad disminuida en Japón y EEUU cuya transcendencia clínica se desconoce. Pero teniendo en cuenta que en caso de alergia a betalactámicos los fármacos alternativos son los macrólidos y clindamicina, y que la resistencia a estos fármacos ha cambiado en los dos últimas décadas de <5% a 20-35%, se recomienda realizarla siempre.
El mecanismo de resistencia más común a estos antimicrobianos es el debido a la producción de una metilasa (MLSB) existiendo dos fenotipos: el constitutivo que hace que el EGB sea fenotípicamente resistente a clindamicina y eritromicina, y el inducible que aparece fenotípicamente como resistente a eritromicina y sensible a clindamicina, por lo que siempre se debe realizar una prueba de aproximación de discos (D-test) para confirmar la sensibilidad a clindamicina. El D-test, según la normativa de EUCAST (European Committee on Antimicrobial Susceptibility Testing), se realiza situando los discos de eritromicina y clindamicina a una distancia de 12-20 mm e incubando 16-20 horas a 35ºC en atmosfera con 4-6% de CO2. El resultado se informará como resistente a clindamicina cuando el halo de inhibición de clindamicina se achata del lado de la eritromicina (formado la letra “D”, D-test positivo) y sensible si este achatamiento no existe. Los aislados de EGB con el fenotipo inducible son minoritarios en España. El otro mecanismo de resistencia (D-test negativo) que implica a la eritromicina pero no a la clindamicina, es el debido a una bomba de expulsión activa (fenotipo M), que afecta a macrólidos de 14 y 15 átomos de carbono (eritromicina, claritromicina y azitromicina) pero no a los de 16 (espiramicina y josamicina) ni a clindamicina. También se han detectado aislados con el fenotipo L que implica una resistencia de bajo nivel a clindamicina.
El objetivo de este estudio fue evaluar el medio cromogénico agar Brilliance™ GBS (Thermo Fisher Scientific™) para la detección de S. agalactiae (EGB) en comparación con otro medio comercial, el Agar Granada (BBLTM).
MATERIAL Y MÉTODO:
Se procesaron un total de 97 muestras de exudado vagino-rectal (408C-Copan) procedentes de mujeres embarazadas de las diferentes consultas de Ginecología y Obstetricia de nuestra área sanitaria (Área de Gestión Sanitaria Norte de Huelva) durante un periodo de tiempo de cuatro meses.
La obtención y el transporte de la muestra son importantes para asegurar un diagnostico correcto. La detección de embarazadas portadoras de EGB debe efectuarse mediante cultivo de muestras de exudado vaginal y rectal realizado en las semanas 35-37 de gestación. La muestra puede obtenerse utilizando un único escobillón. En este caso, se obtendrá primero el exudado vaginal y posteriormente el exudado rectal, introduciendo el mismo escobillón en el esfínter anal. También pueden obtenerse las muestras utilizando escobillones diferentes para la obtención de la muestra vaginal y rectal. En nuestro estudio utilizamos un único escobillón.
La muestra de exudado vaginal ha de obtenerse antes de cualquier manipulación vaginal, no deben utilizarse productos de higiene femenina antes de la obtención y la embarazada no debe estar recibiendo tratamiento antibiótico. La muestra debe obtenerse del tercio externo de la vagina (sin usar especulo) y de la zona anorrectal (introduciendo el escobillón a través del esfínter anal). Los escobillones se introducirán en un medio de transporte adecuado y se enviarán al laboratorio el mismo día de la obtención. Si ello no es posible, pueden conservarse hasta 24 horas en frigorífico antes de su envío al laboratorio.
Se procedió a la siembra directa en los medios de cultivo Agar Granada y Agar Brilliance™ GBS, siembra cualitativa con asa calibrada después de una descarga inicial con los hisopos en ambos medios.
El medio de agar Granada se incubó a 37ºC en atmosfera de anaerobiosis durante 48 horas y el medio Brilliance™ GBS fue incubado a 37ºC durante 24 horas en atmósfera aeróbica, siguiendo las recomendaciones de ambos fabricantes.
Se realizaron lecturas de ambos medios a las 22-24 horas y en el caso del Agar Granada se realizó una segunda lectura a las 48 horas en aquellos casos en los que a las primeras 24 horas no se había detectado crecimiento de EGB.
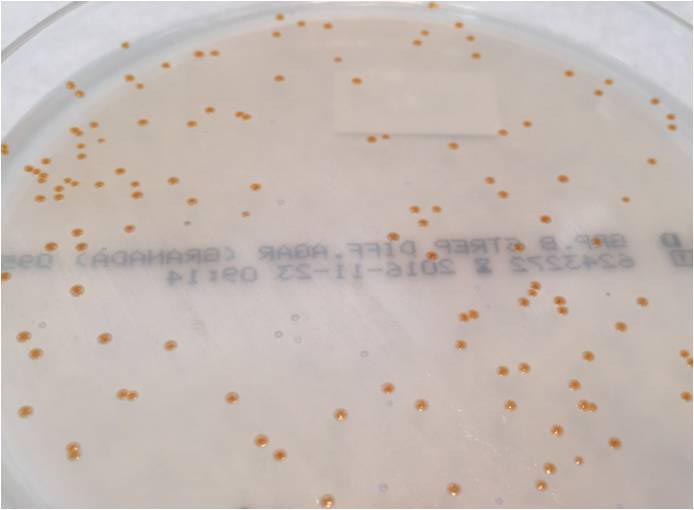
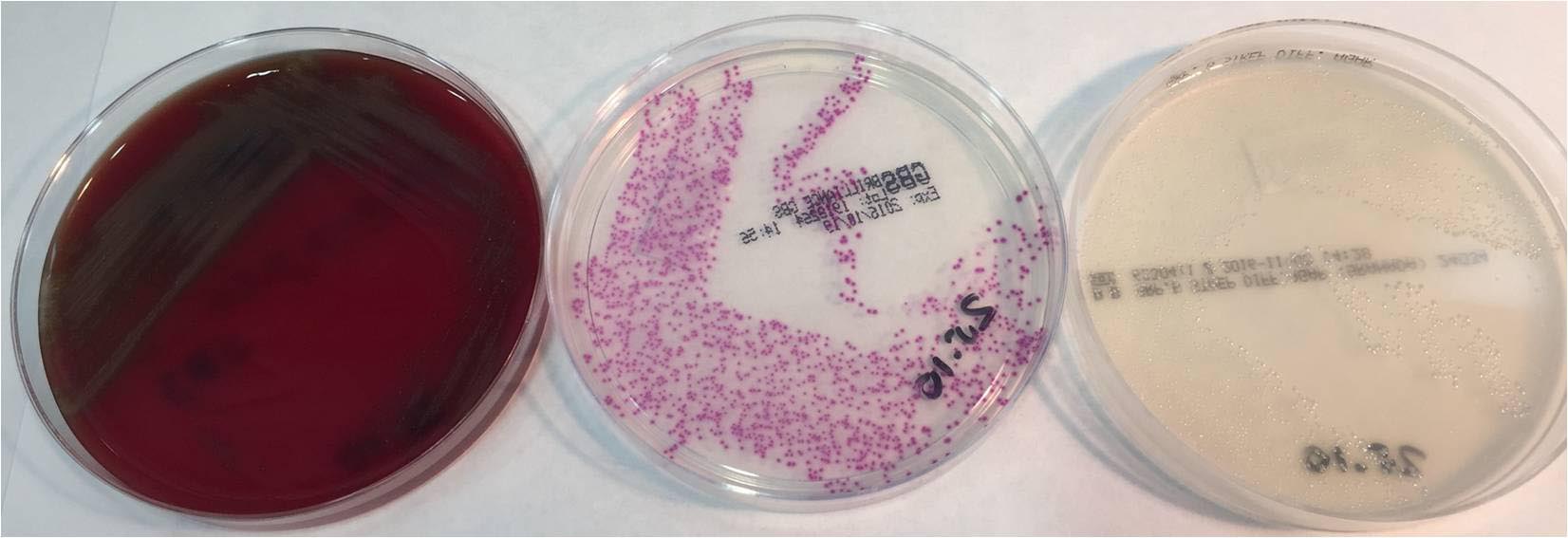
Basándonos en el color de las colonias, el crecimiento de aquellas con pigmento de color naranja en el Agar Granada, fueron consideradas como S. agalactiae, sin confirmación de la identificación.
Aquellas colonias que fueron presuntivas de ser EGB por presentar una producción de un pigmento rosa intenso en el medio Brilliance™ GBS, se procedió a su subcultivo en Agar Sangre (Thermo Fisher Scientific™) para su posterior identificación mediante prueba de aglutinación con látex específico frente a Streptococcus agalactiae (PastorexTM Strept B. BioRad). Aquellos aislamientos con aglutinación negativa, fueron identificados mediante espectrofotometría de masas (Maldi-Toff MS).
Cada laboratorio debe controlar que su técnica de detección de EGB tenga la sensibilidad adecuada, lo cual puede inferirse de la frecuencia de portadoras de EGB detectada, que no debe ser inferior al 15%. Esto es fundamental con las placas de medio Granada, pues se observan resultados no satisfactorios en algunos lotes de medio.
En nuestro estudio, todas las placas de Agar Granada, se incubaron en anaerobiosis aunque se puede utilizar como alternativa, aunque menos satisfactoria a la incubación en anaerobiosis, incubar las placas de agar Granada en aerobiosis y colocar un cubreobjetos sobre el inóculo para facilitar la producción de pigmento por las colonias de EGB.
Debemos ser cuidadosos respecto a la siembra de múltiples escobillones de diferentes pacientes en una única placa de medio, pues puede producirse contaminación cruzada. En nuestro estudio hemos utilizado una placa por paciente por lo que eliminamos una posible contaminación cruzada.
La siembra de los medios cromogénicos ha de efectuarse de forma que se obtengan colonias bien aisladas, pues en cultivos polimicrobianos con escasa cantidad de EGB las colonias de EGB pueden ser difíciles de detectar.
Un escaso número de cepas de EGB (3-5%) son no hemolíticas y no pigmentadas y se consideran menos virulentas. Estas cepas crecen en medio Granada, como colonias blancas no pigmentadas, y en agar sangre, como colonias no hemolíticas. La detección de estas cepas requiere el empleo de técnicas microbiológicas habituales no basadas en la detección del pigmento característico de EGB.
El agar Brilliance™ GBS es un medio transparente que incorpora dos cromógenos. Uno de los cromógenos ofrece un color magenta debido a la actividad de la fosfatasa en los EGB. Para facilitar la diferenciación exacta de los EGB, se incluye un segundo cromógeno. Las colonias que no son de EGB presentan un color azul/morado oscuro en el agar Brilliance™ GBS. Los componentes antimicrobianos del medio suprimen el crecimiento de los estreptococos del grupo A y C. También se incluyen compuestos que inhiben el crecimiento de Enterobacteriaceae, estafilococos, enterococos y otros estreptococos del grupo D. Los antifúngicos eliminan la flora de levaduras de fondo. Además, el agar Brilliance™ GBS incorpora la tecnología Inhibigen™ que inhibe de forma selectiva el crecimiento de enterococos y estreptococos del grupo D, de modo que asegura unos altos niveles de sensibilidad y especificidad.
RESULTADOS:
Se procesaron un total de 97 muestras de las cuales en 11 (11.34%) se detectó crecimiento de EGB en ambos medios de cultivo. (Imagen 1, 2, 3 y 4).

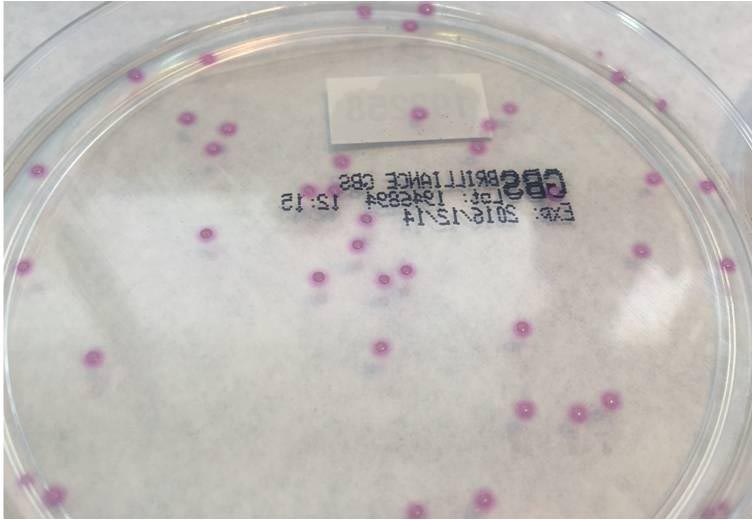
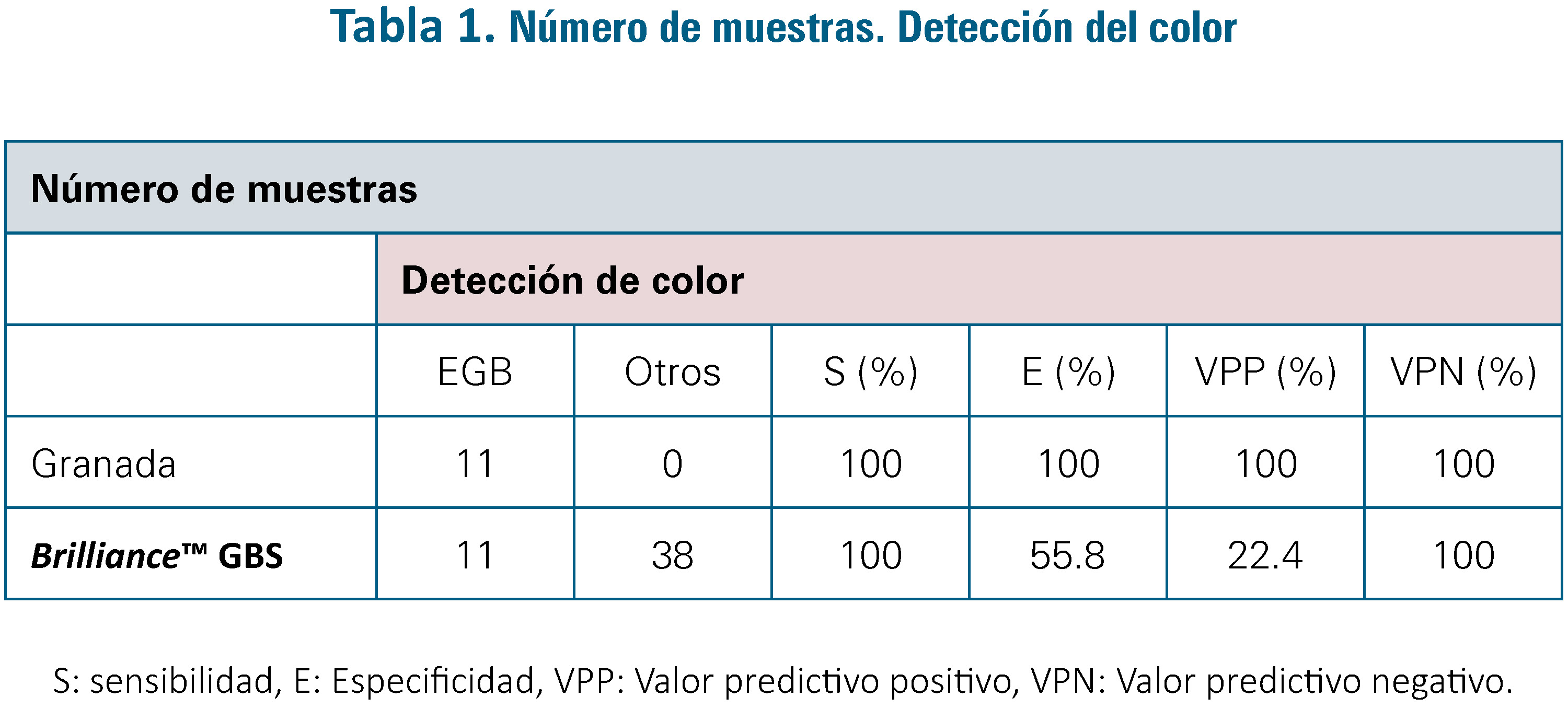
En 38 muestras (39,17%), se detectaron colonias con pigmento rosa, compatibles con EGB en el medio de Brilliance™ GBS mientras que en el medio de agar Granada no se detectó pigmento. (Tabla 1)
No se ha detectado, en ninguna muestra, crecimiento de EGB en el medio de Granada y ausencia de pigmento en el medio Brilliance™ GBS.
A todas las cepas compatibles en su pigmentación con EGB, que fueron detectadas en el medio Brilliance™ GBS y aglutinación con látex negativa, se les realizó una resiembra en Agar Sangre y una posterior identificación mediante espectrofotometría de masas Maldi-Toff, identificándose los aislados como: Streptococcus salivarius (16), Streptococcus oralis (12), Streptococcus anginosus (5), Lactobacillus spp. (3), Staphylococcus spp. (1), y Corynebacterium spp. (1). (Imagen 5 y 6)
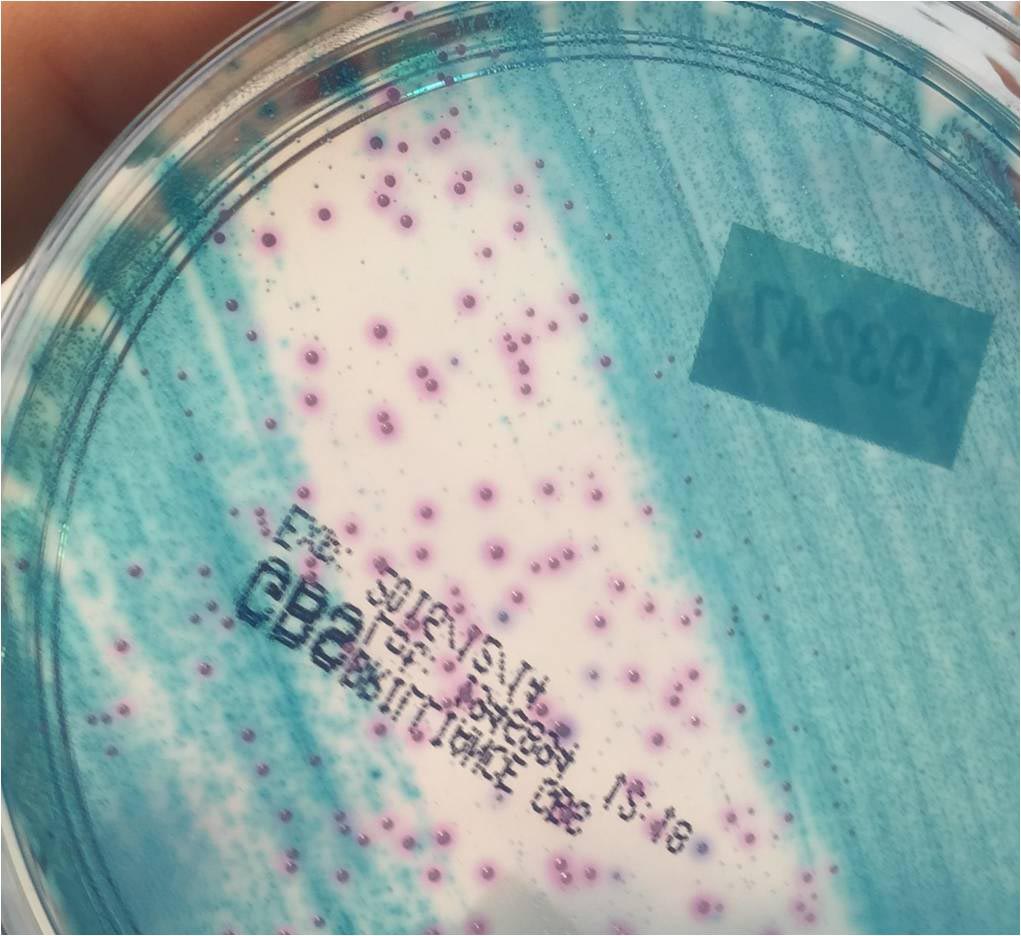
En la valoración de los cultivos negativos se debe tener en cuenta la posibilidad de que el paciente haya recibido tratamiento antibiótico previo a la obtención de la muestra.
Si se considera relevante el hallazgo, se avisará al clínico responsable del paciente. Se identificarán todos los aislados clínicamente significativos a nivel de especie y se realizarán las pruebas de sensibilidad a los antibióticos según las normas de cada laboratorio.
CONCLUSIONES:
Este estudio evaluó el nuevo medio Brilliance™ GBS para el cribado de EGB en muestras vagino-rectales de mujeres embarazadas.
Aunque ambos medios han mostrado resultados similares en la detección del EGB, las diferencias en el flujo de trabajo diario han sido grandes(7).
El medio Brilliance™ GBS mostró una elevada sensibilidad pero una baja especificidad, por la cantidad de colonias pigmentadas que no se trataban de EGB (falsos positivos), destacando la necesidad de pruebas adicionales para realizar una identificación final y definitiva de EGB (pruebas de aglutinación o Maldi-Toff MS).
Hay que tener en cuenta que desde el punto de vista clínico, los falsos positivos en la detección del EGB, podría implicar la administración innecesaria de antibióticos a las mujeres embarazadas(8).
Como aspecto positivo, a diferencia del Agar Granada, el medio cromogénico Brilliance™ GBS no requiere atmósfera anaeróbica, y el tiempo de incubación necesario son 24 horas.
Las recomendaciones de actuación ante cualquier RN con signos o síntomas de sepsis (independientemente de si la madre es o no portadora de EGB), con profilaxis antibiótica intraparto (PAI) o sin ella, será someter al RN a evaluación diagnóstica completa: hemocultivo, recuento y fórmula leucocitaria, plaquetas, proteína C reactiva y estudio de líquido cefalorraquídeo y radiografía de tórax si hay anormalidades respiratorias. Asimismo, se iniciará tratamiento inmediato con antibióticos activos frente a EGB y otros microorganismos que son agentes causales de infección neonatal(3).
El medio de Granada en placa es un medio selectivo y diferencial aunque no de enriquecimiento, para EGB. Los antimicrobianos que lleva incorporados permiten la inhibición de bacterias gramnegativas, estafilococos y levaduras, y facilita el crecimiento de estreptococos y enterococos.
Recientemente, algunos autores han descrito que la incubación de las placas de medio de Granada en aerobiosis, tras cubrir la zona inoculada con un cubreobjetos, permite el mismo desarrollo de pigmento que su incubación en condiciones de anaerobiosis. En nuestro estudio todas las placas de Agar Granada han sido incubadas en anaerobiosis; no podemos valorar lo descrito por otros autores en lo referente al modo de incubacion en aerobiosis. Por otra parte, algunos autores han desaconsejado el empleo del medio de Granada en tubo ya que, en determinadas condiciones, puede producir un número importante de falsos negativos (10).
CONCLUSIONS
This study evaluated the new Brilliance™ GBSmedium for the screening of GBS in vaginorectal samples of pregnant women. Although both media have shown similar results in the detection of GBS, the differences in daily workflow have been large (7).
The Brilliance ™ GBS medium showed high sensitivity but low specificity, due to the number of pigmented colonies that were not GBS (false positives), highlighting the need for additional tests to perform a final and definitive identification of GBS (agglutination tests). or Maldi-Toff MS).
It must be borne in mind that from the clinical point of view, false positives in the detection of GBS could imply the unnecessary administration of antibiotics to pregnant women (8).
As a positive aspect, unlike the Granada Agar, the Brilliance ™ GBS chromogenic medium does not require an anaerobic atmosphere, and the necessary incubation time is 24 hours. The recommendations for action against any newborn with signs or symptoms of sepsis (regardless of whether the mother is or is not a carrier of GBS), with or without intrapartum antibiotic prophylaxis (PAI), will be subject to a complete diagnostic evaluation: blood culture, counting and leukocyte formula, platelets, C-reactive protein and study of cerebrospinal fluid and chest x-ray if there are respiratory abnormalities. Likewise, immediate tre atment will be initiated with active antibiotics against GBS and other microorganisms that are causative agents of neonatal infection (3).
The medium of Granada in plate is a selective and differential medium, although not enrichment, for EGB. The incorporated antimicrobials allow the inhibition of gram-negative bacteria, taphylococci and yeasts, and facilitates the growth of streptococci and enterococci.
Recently, some authors have described that the incubation of the plates of Granada medium in aerobiosis, after covering the area inoculated with a coverslip, allows the same development of pigment as its incubation in conditions of anaerobiosis. In our study all the Granada Agar plates were incubated in anaerobiosis; We can not assess what has been described by other authors regarding the mode of incubation in aerobiosis. On the other hand, some authors have discouraged the use of the medium of Granada in tube since, under certain conditions, it can produce a significant number of false negatives (10).
1. Camacho-Gonzalez A, Spearman PW, Stoll BJ. Neonatal infectious diseases: evaluation of neonatal sepsis. Pediatric clinics of North America. 2013;60(2):367-89.
2. Verani JR, McGee L, Schrag SJ, Division of Bacterial Diseases NCfI, Respiratory Diseases CfDC, Prevention. Prevention of perinatal group B streptococcal disease--revised guidelines from CDC, 2010. MMWR Recommendations and reports: Morbidity and mortality weekly report Recommendations and reports. 2010;59(RR-10):1-36.
3. Alos Cortes JI, Andreu Domingo A, Arribas Mir L, Cabero Roura L, de Cueto López M, López Sastre J, et al. [Prevention of Neonatal Group B Sreptococcal Infection. Spanish Recommendations. Update 2012. SEIMC/SEGO/SEN/SEQ/SEMFYC Consensus Document]. Enfermedades infecciosas y microbiología clínica. 2013;31(3):159-72.
4. Cagno CK, Pettit JM, Weiss BD. Prevention of perinatal group B streptococcal disease: updated CDC guideline. American family physician. 2012;86(1):59-65.
5. Di Renzo GC, Melin P, Berardi A, Blennow M, Carbonell-Estrany X, Donzelli GP, et al. Intrapartum GBS screening and antibiotic prophylaxis: a European consensus conference. The journal of maternal-fetal & neonatal medicine : the official journal of the European Association of Perinatal Medicine, the Federation of Asia and Oceania Perinatal Societies, the International Society of Perinatal Obstet. 2015;28(7):766-82.
6. Rodriguez-Granger J, Alvargonzalez JC, Berardi A, Berner R, Kunze M, Hufnagel M, et al. Prevention of group B streptococcal neonatal disease revisited. The DEVANI European project. European journal of clinical microbiology & infectious diseases: official publication of the European Society of Clinical Microbiology. 2012;31(9):2097-104.
7. Verhoeven PO, Noyel P, Bonneau J, Carricajo A, Fonsale N, Ros A, et al. Evaluation of the new brilliance GBS chromogenic medium for screening of Streptococcus agalactiae vaginal colonization in pregnant women. Journal of clinical microbiology. 2014;52(3):991-3.
8. Committee on Infectious D, Committee on F, Newborn, Baker CJ, Byington CL, Polin RA. Policy statement-Recommendations for the prevention of perinatal group B streptococcal (GBS) disease. Pediatrics. 2011;128(3):611-6.
9. Susana Delgado, Fernando García-Garrote, Belén Padilla, Juan Miguel Rodríguez Gómez, Beatriz Romero. Procedimiento en Microbiología Clínica. Procedimiento 54: Diagnóstico microbiológico de la infección bacteriana asociada al parto y al puerperio. 2015
10.- Bosch-Mestres J, Martín-Fernández R y Jiménez de Anta-Losada MT. Servicio de Microbiología. Institut Clínic d’Infeccions i d’Immunologia. Corporació Sanitària Clínic. Barcelona. España.2016
11. Claeys G, Verschraegen G, Temmerman M. Modified Granada agar medium for the detection of group B Streptococcus carriage in pregnant women. Clin Microbiol Infect 2001;7:22-4.
12. De la Rosa M, Pérez M, Carazo C, Pareja L, Peis JI, Hernández F. New Granada medium for detection and identification of group B streptococci. J Clin Microbiol 1992;30:1019-21.
13. Uh Y, Jang IH, Yoon KJ, Lee CH, Kwon JY, Kim MC. Colonization rates and serotypes of group B streptococci isolated from pregnant women in a Korean tertiary hospital. Eur J Clin Microbiol Infect Dis 1997;16:753-6.
14. Reardon EP, Noble MA, Luther ER, Wort AJ, Bent J, Swift M. Evaluation of a rapid method for the detection of vaginal group B streptococci in women in labor. Am J Obstet Gynecol 1984;148:575-8.
15. Votava M, Tejkalowa M, Drabkova M, Unzeiting V, Braveny I. Use of GBS media for rapid detection of group B streptococci in vaginal and rectal swabs from women in labor. Eur J Clin Microbiol Infect Dis 2001;20:120-2.
16. Rosa-Fraile M, Rodríguez-Granger J, Cueto-López M, Sampedro A, Biel-Gaye E, Haro JM, et al. Use of Granada medium to detect group B streptococcal colonization in pregnant women. J Clin Microbiol 1999; 37:2674-7.
17. Gil EG, Rodríguez MC, Bartolomé R, Berjano B, Cabero L, Andreu A. Evaluation of the Granada agar plate for detection of vaginal and rectal group B streptococci in pregnant women. J Clin Microbiol 1999;37:2648-51.























